5.1 前言
维生素是维持人十体正常功能的一类低分子有机化合物,他们在体内不能合成或合成量不足,虽需要量很小,但必须由食物供给。
实验动物(大白鼠、豚鼠、犬、猴、鸡、鸽)以及微生物也需要维生素,因此常作为发现新维生素的实验动物,并观察缺乏症及探究其作用机理。
维生素可分为脂溶十性十及水溶十性十两大类。前者有A、D、E、K,不溶于水,而溶于脂肪及脂溶剂中,在食物中与脂类共同存在,在肠道吸收时与脂类吸收密切相关。当脂类吸收不十良时,如胆道梗阻或长期腹泻,他们的吸收大为减少,甚至会引起缺乏症。水溶十性十维生素为B族维生素及维生素C。B族维生素是辅酶的组成部分。含B族维生素的辅酶列于表5-1中。B族维生素中的B6、泛酸及生物素在食物中广泛存在,肠道细菌又可合成,人类未发现典型的缺乏症。
表5-1 含有B族维生素的辅酶
| 维生素 | 辅酶 | 转移基十十团十十 |
| 尼克酰胺 | 辅酶Ⅰ(NAD+) | 氢原子 |
| 同上 | 辅酶Ⅱ(NADP+) | 氢原子 |
| 核黄素(维生素2) | 黄素单核苷酸(FMN) | 氢原子 |
| 核黄素(维生素2) | 黄素腺嘌呤二核某酸(FAD) | 氢原子 |
| 硫胺素(维生素B1) | 焦磷酸硫胺素 (TPP) | 醛类 |
| 泛酸 | 酶A(HscOA或cOA) | 酰基 |
| 钴胺素(维生素B12) | 钴胺素辅酶 | 烷基 |
| 生物素 | 生物胞素(ε-N-生物素酰-1-赖氨酸) | CO2 |
| 维生素B6 | 磷酸吡哆醛 | 氨基 |
| 叶酸 | 四氢叶酸辅酶类 | 一碳化合物 |
人十体要靠食物来供给维生素。食物不足或食物供应单调的国家,人群容易有营养缺乏病。第三世界国家除热量与蛋白质供应不足外,维生素也易有缺乏的现象。亚、非洲有许多儿童由于缺乏维生素A而致盲。解放前,我国内忧外患十十交十十迫,人民缺衣少食,维生素缺乏病并非罕见,侯祥川在上海难民营的调查中发现许多典型维生素缺乏的病例。解放后,人民生活改善,维生素缺乏病显著减少。但由于我国以植物十性十为主,动物十性十食物较少,所以维生素A及核黄素供应量偏低。因此,仍有散见的夜盲、舌炎、十陰十囊皮炎等维生素A及B2缺乏的症状。
(1)维生素摄取量不足 膳食调配不合理,或有偏食十习十惯以致维生素摄取不足。有引起地区食物单调,如以玉米为主,则易患尼克酸缺乏的癞皮病。
(2)吸收不十良 多见于消化系统疾病的患者,如长期腹泻,消化道或胆道梗阻者。
(3)肠道细菌生长抑制 使用杀菌药物而使消化道细菌受到抑制,合成维生素的量减少,也可引起某些维生素(K、B6、尼克酸)的缺乏。
(4)需要量增加 生长期儿童、妊十娠和哺十乳十期的妇女,重体力劳动及特殊工种的工人及长期高热和患慢十性十消耗十性十疾患的病人等,需要量比一般人要高。
(5)食物储存及烹调方法不当 弃掉烹调用水,则使水溶十性十维生素损失。煮粥或?l肉时加碱,维生素B1便破坏。维生素C在储存及烹调时最易破坏。我国膳食中蔬菜较多,但以熟食为主,所以实际摄取量比按新鲜样品的计算值要小。
有些维生素的营养评价指标、缺乏症状、防治措施以及毒十性十等将在有关缺乏病的各章叙述。本章叙述的临十床十应用着重于防治缺乏病外的使用。食物的维生素含量已收录在食物成分表者,不另列入。未列入者,作了扼要简短的介绍。
5.2 维生素A
(1)维生素A 维生素A亦名视黄醇(Retinol,VA),在自然界中的多是全反式棕榈酸酯。他的衍生物具有特殊的生理功能,如视黄醛(Retinyl Aldehyde,VA醛)对暗适应有效;甘露糖视黄醇磷酸(MannosylRetiny Phosphate,MRP)也具有某些生理功能。VA衍生物的分子式列于图5-1,活十性十列于表5-2。
维生素A及其衍生物易氧化。氧化剂MnO2可使之成为醛,还原剂双可将维生素A酸还原到要醛或醇。对碱较稳定,但对酸不稳定,使其脱氢或将双键重新排列。在光或碘的作用下,全反式可变为较稳定的11顺式异构体。在强光下形成二聚体或多聚体。
(2)十胡十萝卜素 植物中十胡十萝卜素在体内分解为维生素A,并具有维生素A的生理作用。
表5-2 维生素A及基其衍生物的活十性十
| 化学变化 | 产物 | 生物活十性十 |
| 酯化 | 自然及人工产品 | 100 |
| 氧化 | 醛 | 100 |
| 顺式异构 | 顺式异构体 | 23~75 |
| 醚 | 苯及甲基醚 | 10~100 |
| 脱氢 | 维生素A2(3-脱氢视黄醇) | 30 |
| 失去氧 | Axerophene | 10 |
| 酮 | C21-酮 | 3 |
| 去甲基 | 新维生素A | 3 |
| 增加-CH2- | 高维生素A | 1.5 |
| 脱水 | 脱水维生素A | 0.4 |
| 氧化 | 环氧物 | 0 |
| 氢化 | 二氢维生素A等 | 0 |
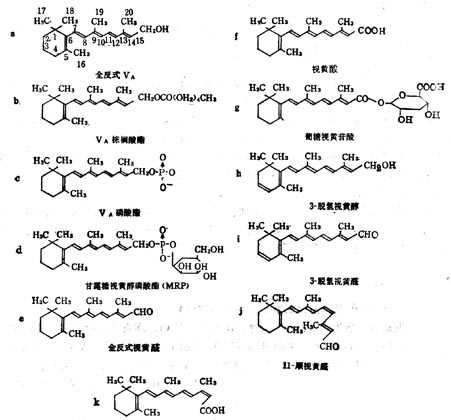
图5-1 维生素A衍生物的分子式
β-十胡十罗卜素含有两个β-紫罗兰酮环(β-Ionone ring)和四个异戊二烯侧链,加水断裂为两分子维生素A如图5-2。但实际上膳食中β-十胡十萝卜素只有1/6右变为维生素A。自然界中有环与维生素A相同,他们的维生素A活十性十低于β-十胡十萝卜素,有的没有与维生素A相似的环,没有生物活十性十(表5-3,5-4)。
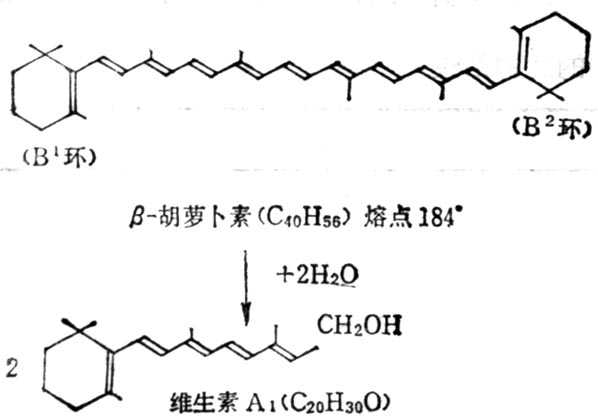
图5-2 β-十胡十萝止素水解为维生素A
5.2.2 维生素A及十胡十萝卜素的代谢
(1)十胡十萝卜素的吸收 十胡十萝卜素的微胶粒溶液在小肠内吸收。油溶液中者吸收最好,磷脂有助于形成微胶粒溶液而利于吸收。胆盐不但促进十胡十萝卜素运输至肠细胞,助其与细胞表面相结合,并促进十胡十萝卜素的分解。维生素E及其他抗氧化剂可保护侧链的共轭双键系统免于氧化。十胡十萝卜素进入到小肠细胞内,在胞浆内十胡十萝卜素双氧化酶(Carotene Dioxygenase)作用下,将1mol氧加入到中间位置的双键上,将其分解为视黄醛,但也可从一端将其分解生成具有与维生素A相同的环,侧链较长的醛即apo十胡十萝卜醛。所生成的醛双为脱氢酶作用还原为醇再酯化。小肠及肝都有十胡十萝卜素双氧化酶,但其活力以小肠中者较高,以器官计,肠为肝的2倍,以重量计为4~7倍。静脉注射β-十胡十萝卜素,在肝中也可转变为视黄醇,也以视醇酯形式储存,但能力有限。
十胡十萝卜素吸收是扩散十性十的,其吸收量与剂量大小有相反关系。类十胡十萝卜素都可吸收进入血浆内。血浆中的类十胡十萝卜素可分为β-十胡十萝卜素、叶黄素,番茄红素及其他类十胡十萝卜素,视摄入情况而定。可存在于肝、脂肪、肾、皮肤及血管粥样硬化的斑块中。
表5-3十胡十萝卜素化合称的环结构
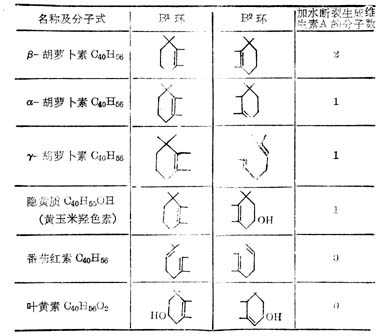
表5-4 类十胡十萝卜素化合物的生物活十性十(以β-十胡十萝卜生物活十性十为100%)
| 类十胡十萝卜素 | 活十性十 | 类十胡十萝卜素 | |
| β-十胡十萝卜素 | 100 | β-半十胡十萝卜素 | 有 |
| α-十胡十萝卜素 | 50~54 | β-apo-8'-十胡十萝卜醛 | 72 |
| γ-十胡十萝卜素 | 42~50 | β-apo-8'-十胡十萝卜酸 | 有 |
| β-新十胡十萝卜素 | 20~40 | 脱水叶黄素 | 21 |
| 3,4去氢-β-十胡十萝卜素 | 75 | 玉米黄素(隐黄质) | 57 |
| β-十胡十萝卜素 | 21 | 反-顺异构体比全反式的活十性十要小 | |
| β-十胡十萝卜素 | 50 |
(2)维生素A的吸收及储存维生素A为主动吸收,需要能量,速率比十胡十萝卜素要快7~30倍。食物中的维生素A为酯式,经肠中胰液或绒十毛十刷状缘中的视黄酯水解酶分解为游离式进入到小肠十壁内,又为肠内细胞微粒体中的酯酶所酯化,合成维生素A棕榈酸酯,摄取维生素A3~5h后,吸收达到高十峰。维生素A也需要胆盐。维生素E也可防止维生素A氧化破坏。维生素A与十乳十糜微粒相结合由淋巴系统输送到肝,酯式水解进入肝,然后又再酯化为棕榈酸酯。肝实质细胞负责摄取及新进入的维生素A代谢,一部分维生素A由实际细胞转入类脂储存细胞(Lipocyte),这种细胞中有许多类脂滴,如维生素A摄取量大,这些类脂滴大而多。85%的维生素A在类脂滴中,还有一些在高尔基体中。
维生素A的吸收与储存量均较大,大鼠每可吸收20,000IU。若维生素A摄入速度很快,VA酯与脂蛋白的结合已达饱合,多余者以酯式流入到血浆中。每日给大鼠50,000IU,4周后给以无维生素A膳食3周,血浆中维生素A酯较正常者多,而维生素A值正常。一方面由于组织的需要,维生素A从肝中释放经十血流到靶组织,另一方面过剩的维生素A也从肝到血流中。
高蛋白膳食可以增加维生素A的利用,因而加速维生素A储存的空竭(Depletion)。蛋白质营养不十良时,维生素A的吸收及十胡十萝卜素转变为维生素A的能力都受到影响,因而使维生素A的肝储存量降低。怀孕可使储存量增加,大鼠孕娠17~21天时,肝储存可增加2倍,为制造维生素A丰富的初十乳十及十乳十汁作准备。胎儿维生素A储存量甚少,不受母亲营养情况的影响。初生婴儿肝维生素A浓度仅为成十人1/10。60岁以后储存量又低于成十人。肝储存量可能与十性十别有关系,雌鼠比雄鼠储存较多。吃维生素A缺乏饲料,雄鼠肝储存空竭比雌鼠要快。男十性十的血清维生素A水平比女十性十稍高。夜盲的发生亦以男十性十较多。肾脏内也能储存维生素A,但其量仅为肝的1%。眼色素上皮组织内的维生素A是以酯式存在的,专为视网膜使用而储备,其空竭速率比肝中者要慢一些。
(3)维生素A的运输当靶组织需要维生素A时,维生素A从肝中释放出来,运输到靶组织。这个过程首先将肝内储存维生素A酯经酯酶水解为醇式,与视黄醇结合蛋白(Retionl BindingProetin,RBP)结合,再与前白蛋白(Prealbumin,PA)结合,形成维生素A-RBP-PA复合十体后,才离开肝脏。经十血流入靶组织。维生素A在一般情况下必须与蛋白质结合,使之具有水溶十性十,并较稳定。此外,还可减少维生素A对细胞的毒十性十,因细胞膜对复合十体有识别能力,但对未结合的维生素A无识别力,以致对维生素A的摄取失去控制,过多维生素A进入细胞而产生毒十性十。
RBP为肝实质细胞合成的多肽,分子量21,000,电泳在α部分。肝每天能合成190mg,一分子RBP与一分子维生素A结合。维生素A-RBP-PA进入血流中,由于分子较大,不能从肾脏滤出。血流中RBP的水平受维生素A的影响,如果无维生素A可资运输时,RBP则积累于肝内。正常血浆RBP水平为40~50μg·m-1,维生素A缺乏的夜盲症状出现时,RBP则降为20μg·m-1。蛋白质缺乏,RBP合成减少,维生素A-RBP不能形成,维生素A结合的RBP-PA,其量为正常值的20%,但已变十性十,不能再与维生素A结合。PA的血浆浓度受维生素A营养状况的影响较少,其正常值为200~300μg·m-1,他不但与RBP结合,而且也与甲状腺素结合,两者互不影响。
维生素A-RBP-PA复合十体随血流到肠粘十膜、膀十胱、角膜及上皮组织等靶细胞后,细胞膜上有RBP的特殊受全,可与RBP结合,并将维生素A释放出来,进入细胞内。RBP与维生素A分开后已变十性十,丧失与维生素A,PA或细胞膜上受体的结合能力。此种游离的RBP在肾小球中可滤过,而在肾小管重吸收,为肾皮层细胞所摄取,并在其溶酶体中分解为氨基酸。血浆中还有一种未与PA结合的维生素A-RBP,其量约为1μg·m-1。这部分可从肾小球滤过,在肾小管中重吸收,并浆维生素A释放出来。因此肾中有少量维生素A积累,然后酯化输送至肝。
维生素A进入到靶细胞后,立即与细胞视醇结合蛋白(Cellular retinol Binding Protein,CRBP)相结合。维生素A酸在运输过程中不需要与RBP相结合,但进入细胞内必须视黄酸结合蛋白相结合。
肝病患者的血浆蛋白合成受到影响,RBP及PA水平偏低而影响维生素A的血浆水平。肾病患者RBP分解代谢减弱,使RBP值增高。但囊纤维变十性十患者,肝内维生素A储存量适当,但血浆中RBP、PA及维生素A的水平均低。RBP也受内泌的调节,雄十性十动物血浆的RBP水平比雌十性十高。月十经十期或口服避孕药的妇女的RBP都有变化。新生儿的RBP只有成十人的一半。这种水平一直维持至青春期,以后将增高。
(4)维生素A分解代谢及排十出维生素A分解代谢途径可能如图5-3。视黄醇通过氧化转变为维生素A酸,其中一部分异构为β顺式。全反式或β顺式者均为维生素A的代谢产物,有维持上皮组织分化的活十性十,但体内不能储存,很快消失。注射维生素A酸4h后,肝中只剩下10%,24h后肝中已无。以后5,6位环氧化形成5,6环氧维生素A酸(5,6-epoxyretinoic acid)或环上4位羟基化,再进一步氧化形成4-氧-络维生素A酸(4-oxo-Retinoicaxcid)或形成葡萄视黄苷酸(retinoylglucronide)。大鼠注射标记维生素A酸后,在胆汁中60%为维生素A酸及基葡萄糖苷酸,少于40%的为13顺式葡糖视黄苷酸,还有少量5,6位从环氧维生素A酸及基葡萄糖视黄苷酸为0.2~0.4μg,这些维生素A代谢从胆汁流入小肠,形成肝肠循环。正常大鼠注射标记维生素A酸2h后,在小肠中的放射十性十约占剂量的7.2%,而胆道插管者仅为2.4%。在肾脏中也有维生素A代谢物。大鼠经胃给以标记的视黄醇或其酯后,在肾脏中除摄入物外,尚有全反式维生素A酸及5,6位环氧维生素A酸,但在血浆中并未发现后者,这种氧化作用可能仅在靶组织(如肾)中发生。他的活十性十仅为维生素A酸之1%,生物半寿期很短。
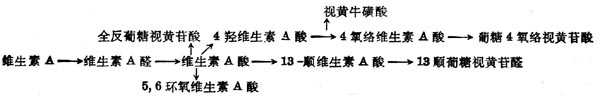
图5-3 维生素A的氧化代谢的可能途径
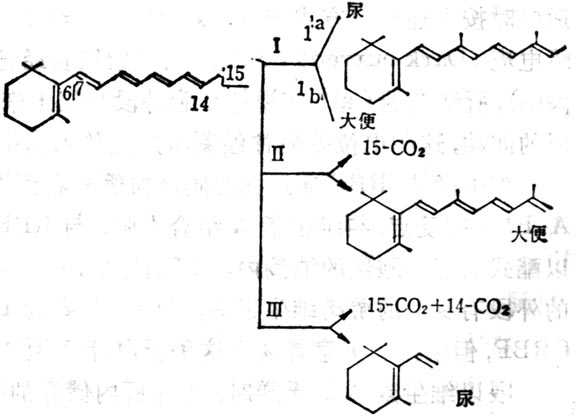
图5-4 维生素A的氧化代谢的可能途径
大鼠摄入维生素A后,大便及尿中都有其代谢物的排十出。2/3排十出物的异戊二烯侧链部分无改变。也有15-C氧化为CO2,有的侧链氧化分解成CO2及短链产品。大鼠给以20μg维生素A后,大便中排十出以葡糖视苷酸为主,为主要排十出途径,大便排十出量变化较大,第2,3天达到高十峰,约为剂量的9%,然后下降到较小数量。尿中排十出24h内为剂量的8.7%,其中一半为水溶十性十者,一半为脂溶十性十者,尿排十出量逐渐下降至第八天达到稳定,约为0.55%。尿中代谢产物β-紫罗兰酮环部分可氧化,甲基可脱十去侧链中的双键可饱合,链也可缩枯木短。水溶十性十代谢物目前了解很少。
肝内储存的及摄入的维生素A都能被补充到需要维生素A的靶组织中去。因此,肝内维生素A的靶组织中。因此,肝内维生素A的储存量能影响维生素A的代谢率(即维生素A转变为尿及大便中维生素A代谢物之量)。SauberLich测定人的代谢率每天570~1250μg,这种差异由于肝储存量不同所致。注射标记维生素A,在试验中,发现维生素A有三种不同速率从尿中排十出,亦即有三种不同代谢库:代谢库1代表新吸收的维生素A;代谢库2代表功能十性十和非功能十性十的维生素A;代谢库3代表功能十性十的代谢。在肝内储存空竭后的代谢率,才代表靶组织的功能十性十代谢率。新吸收的维生素A与体内储存者不同,二者在24h内不混合,血浆中新吸收者占90%,内源者仅占10%,二者逐渐混合,大鼠至第八天才完全混合。如果肝中维生素A储存量少,新吸收者在血浆中比例大,持续时间较长。如果肝储存量为0.6μg·m-1时,新吸收者由于其他维生素A已经空竭,需要维生素A补充,不能储存于肝内,而进入其他组织如肾等。若维生素A储存量较多时,肝储存量为18μg·m-1,60%存于肝内。从代谢库2来看,非功能十性十的代谢,即代表肝储存维生素A的分解。所以维生素A空竭的速率随维生素A储存量的指数而变化。大鼠的维生素A肝储存量可为全部生命需要量的数倍,但也可空竭,人十体也是如此,储存量高代谢率亦高,摄入量高,代谢率也高。
5.2.3 生理功能
维生素A具有维持正常生长、生十殖、视觉及抗感染的功能,但其作用机理迄今尚未完全清楚。
(1)维生素A与视觉的关系视网膜上有两种视细胞,即视杆细胞与视锥细胞,人类前者数量多,与暗视十十党十十有关;后者数量少,与明视觉及色觉有关,他们都有视色素,由视蛋白与生色十十团十十组成。各种动物的细胞的视蛋白不同,生色十十团十十由不同类型的维生素A醛组成。视杆细胞外段含有视色素是感光部分。视杆细胞膜连续不断地内陷,折起形成片层膜结成,每一层膜又由两层脂类分子膜由两层脂类分子膜构成称为双分子膜。视色素镶嵌在这种脂类双分子膜中。视色素视紫红质,由维生素A醛与视蛋白结合而成。维生素A醛由维生素A氧化而来,经异构酶作用使其变为11-顺式维生素A醛。维生素A醛由维生素A氧化而来,经异构酶作用使其变为11-顺式维生素A醛。维生素A醛由视蛋白之间的一级结构是11-顺维生素A醛的醛基与视蛋白中赖氨酸ξ氨基形成希夫碱(Schiff base)键,随之引起视蛋白高级结构改变,产生相互保护的二级结构,在黑暗中非常稳定。当光照时,一个视紫红质接受一个光子后,维生素A醛在11-C上扭成转成全反维生素A醛,视蛋白的立体构形也发生变化,维生素A醛又经视细胞外端的维生素A还原酶使成其变为维生素A,然后由色素上皮细胞微粒体中酯酶将其酯化而储存于色素上细胞内,需要时再异构为11-顺维生素A。暗适应按上述相反方式进行,又形成视紫红质。暗时Na+从视杆细胞内段移到外段,形成暗电流(Dark current flow)。当视紫红质经光异构后变为前光视紫红质(Prelumirhodopsin),所结合的Ca2+在视杆细胞外段释放出来,中止了Na+流动及暗电流,其结果产生电压的波动,这种电位差使神经刺激加强传入脑中发生光感,也可用视网膜电图测定。
维生素A-RBP通过脉络膜微血管分布到视网膜上皮组织,其细胞表面有维生素A-RBP接受点,与维生素A结合力强,与RBP结合弱,维生素A进入到色素上皮细胞内以酯式储存于胞浆的油滴内。暗适应的眼中,有一半的维生素A为11-顺式,在视杆细胞的外段有少量的游离维生素A,其中60%为11-顺式,生理上很重要,视网膜细胞中有CRBP,但视网膜炎患者缺少这种蛋白,因而维生素A不能进入到细胞内。
喂以维生素A缺乏膳食时,首先肝内储存的维生素A释放供给其他组织,肝的储存量下降,血浆维生素A正常。当肝储存量将近空竭时,血浆维生素A水平才下降,但由于视网膜的色素上皮组织有维生素A积累,视紫红质的维生素A醛下降较慢。色素上皮细胞内维生素A缺乏时,才有夜盲症出现。若视杆细胞内视紫红质减少,影响光的吸收,电流也减少。如视紫红质为正常值之74%,光阈上升14倍,若为正常值之16%,光阈上升680倍,维生素A非常缺乏时,光蛋白也减少,视细胞可以溶解。
(2)对糖蛋白质合成的影响 缺乏维生素A的动物的某组织,如小肠、角膜、气管上皮组织及血清等的特殊糖蛋白减少,给以维生素A或维生素A酸可以促进其合成。细胞膜表面的蛋白主要为糖蛋白,细胞膜的功能如接触抑制、分化及识别环境的能力,可能与糖蛋白有关。膜上有糖基视黄醇磷酸,所以,维生素A可能与膜的糖蛋白合成有关。免疫球蛋白也是糖蛋白,维生素A营养状况影响免疫功能,可能与此有关。
糖蛋白的合成步骤,首先为合成多肽链,然后纳入单糖,单糖与多肽链上的丝或苏氨酸的羟基或门冬酰胺相偶联形成糖蛋白。糖蛋白中的糖为甘露糖、岩藻糖、半十乳十糖、葡萄糖及乙酰葡萄胺。糖蛋白的合成需要脂类-糖作为中间体,其中脂类多为异戊二烯醇类的多萜醇或视黄醇。将单糖从GDP-单糖或UDP-章糖转移到维生素A或多萜醇上。如章糖为甘露糖结合到维生素A上,则生成甘露糖视黄醇磷酸酯(Mannosylretinylphosphate,MRP),若结合到多萜醇上生成甘露糖多萜醇磷酸酯(Dilichylphosphomannose,DMP),再将单糖转移至糖蛋白上。
维生素A在糖蛋白合成中变化分为三个步骤:①形成维生素A磷酸酯(Retinylphosphate,RP);②由RP合成MRP,这一步骤在微粒体内合成;③将单糖转移至糖蛋白上(图5-5)。
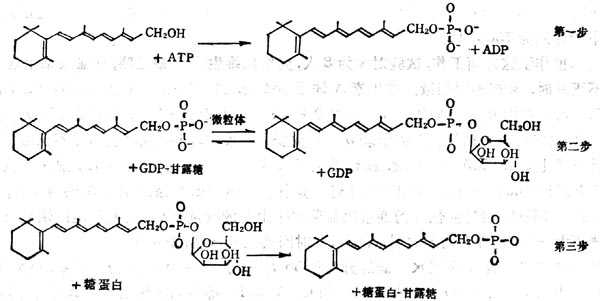
图5-5 VA在糖蛋白合成中的作用
5.2.4 来源
动物的肝、肾、蛋及十奶十中的都有维生素A,尤以肝中最丰富,绿色蔬菜及红黄色蔬菜与水果中有十胡十萝卜素,但各种十胡十萝卜素的生物效用不一样,以β-十胡十萝卜素最高。供应量为1500~4000IU时,食物中1μgβ-十胡十萝卜素相当于0.167μg的维生素A,其他十胡十萝卜素仅为其一半。植物中有些黄红色素并无维生素A的效用(表5-4)。
十胡十萝卜素为脂溶十性十的,在动植物中与脂类相结合,在消化道中可以酶解,烹调中十胡十萝卜素比较稳定。我国的炒菜方法,十胡十萝卜素的保存率为76~94%,如烹调时间短,用水量少,十温十度低都可减少损失。植物老化过程中,十胡十萝卜素转变为环氧化合物,为氧化破坏的第一步。加工烹调及储存过程也容易异构,减少生物活十性十,食物加工中使用亚硫酸,产生自十由基,对十胡十萝卜素也有破坏作用。食品制作方法也影响十胡十萝卜素的利用。十胡十萝卜片的十胡十萝卜素76%由大便排十出,在匀浆中者只有44%排十出。
5.2.5 需要量的研究
VA过去以国际单位IU表示,现在以视黄醇当量RE表示,
1视黄醇当量=1μg维生素A
二次大战时,英国医学研究会给16人以维生素A缺乏膳食作为试验组,为期61/2~25个月。7人为对照组(其中2人每日补充25IU维生素A,5人每日补充5000IU十胡十萝卜素)。当被试者有缺乏症状后,补充不同剂量的维生素A或十胡十萝卜素以测定需要量,在此研究中观察指标较多,但仅血浆维生素A及暗适应较为灵敏。结果最低需要量为1300IU维生素A,1500IU十胡十萝卜素(从大便中排十出者不计算在内),正常需要量为2500IU维生素A,十胡十萝卜素为3000IU,但各种食物的十胡十萝卜素有效剂量不一样,所以正常需要量以食物中十胡十萝卜素计应为7500IU。
美军也作了这方面工作,试验对象为8人,先给以维生素A缺乏膳,在血浆维生素A及视力不正常时,补充不同剂量。维生素A缺乏184天,血浆维生素A从57~78μg%降至20~32μg%。视力及血浆维生素A显出缺乏症的最短时间为361天,最长为771天。血浆维生素A浓度与缺乏症的关系列于表5-5。皮肤角化发生较早,视网膜电图不正常发现较晚。补充维生素A37.5~150,血浆维生素A上升不明显,补充300μg,血浆维生素A略有上升,补充600μg者,明显上升,补充十胡十萝卜素1200μg,血浆维生素A略有上升,补充2400μg上升较快,暗适应恢复的剂量比浆水平上升的剂量要小,视网膜电图恢复正常的剂量要更大一些,若摄入同等的剂量。则恢复时间要延长一些(表5-6)。
我国曾将维生素A血浆水平低的男青年56人(血浆30~65IU),分成7组,每组8人,分别给以400,2000,3100,3500,3800,4500,5500IU等不同剂量维生素A。试验期为11周,观察血浆维生素A、暗适应及生理盲点的变化,每日摄入2000~3000IU者,血浆维生素A水平略有上升,但未达到100~120IU%,3500~5000IU者,在9周时使血浆维生素A达到100IU%,11周时维持在107~130IU%,这次试验未观察到暗适应的变化,但在试验初期,几乎所有试验对象都有生理盲点扩大的现象,摄取量为400IU者,生理盲点继续扩大,一次1,000,000IU大剂量,24h内恢复正常。摄取量2000~3000IU两组,至11周时恢复正常,摄取量3500IU以上的各组,至5~9周时大都恢复正常。因此,维生素A供应量为3500IU时,不仅能使血浆维生素A达到正常,而且生理盲点也正常。上述三次人十体试验的地区、人种、工作不同,但其维生素A正常需要量均为1200~1300μg。
表5-5 美军维生素A缺乏症状与相应的血浆浓度
| 维生素A血浆浓度μg% | |||
| 被试者 | 暗适应不正常 | 视网膜电图不正常 | 皮肤角化 |
| 1 | 22~24 | 9~11 | 29~35 |
| 2 | 25~30 | 未发现 | 32~37 |
| 3 | 20~25 | 未发现 | 29~38 |
| 4 | 4~5 | 7~10 | 20~25 |
| 5 | 4~8 | 4~8 | 5~10 |
| 65 | 30~35 | 未发现 | 25~30 |
| 7 | 2~5 | 5~9 | 13~ 20 |
| 8 | 3 | 5~10 | 20 ~ 24 |
表5-6 美军维生素A需要量
| 维生素A需要量 | ||
| 维生素A(μg/日) | β-十胡十萝卜素(μg/日) | |
| 暗适应正常 | 150~300 | 300~600 |
| 视网膜电图正常 | 300~600 | 600~1200 |
| 皮肤正常 | 600 | 1200 |
| 血浆维生素A水平大于20μg% | 600 | 1200 |
| 大于30μg% | 1200 | 2400 |
①血浆30μg%以上肝储存量为中等水平。维生素A代谢率为570~1250μg。
5.2.6 临十床十应用
维生素A除用以防治缺乏病外,尚用以治疗皮肤角化,并对某些癌有预防作用。
(1)维生素A与皮肤病维生素A可抑制皮肤角化,维生素A酸也有这种功能,但它不储存于肝内,运输不需要RBP,可进入组织中,迅速代谢,很快从体内消失,毒十性十较少。所以用维生素A酸及其衍生物治疗十毛十囊角化、痤疮等。β-顺式维生素A及芳十香族维生素A酸衍生物(如Etretinate)疗效分别为全反式维生素A酸的2.5及10倍。β-顺式维生素A酸用以抑制皮脂形成治疗痤疮有效。用Etretinate治疗牛皮癣及其他衍生物可迅速达到上皮真皮。
(2)维生素A癌维生素A可维持正常上皮组织的分化,维生素A缺乏的某些组织的形态变化与某些上皮组织癌症的早期病变(癌前期)相近,都是上皮组织鳞状变形。因此,维生素A可能在这一阶段中,对癌细胞起回转修复作用。维生素A缺乏,可能增加某些靶组织对致癌物质的敏十感十性十。维生素A只在癌前期起作用,到第三期癌出现后已无效。大鼠的试验证实上述说法。
摄取大量的维生素A,储存于肝,血液中含量受到RBP的 限制,到靶组织之量有限。预防癌变也多用维生素A酸。现在正研制无毒或毒十性十较小而又能作用于靶组织的维生素A酸衍生物:①β-紫罗兰酮环的改变,β变为α,或变为二甲基乙酰戊烯环。如3甲基甲氧基环已烯环酸即Etretinate,可以有效地减低吸烟者的气管组织变形,膀十胱癌复发病也减低;②侧链上的改变,9,11,13共轭双键为维生素A活十性十必要部分,必须保留。顺式异构体有活十性十,β-顺式维生素A酸最先临十床十应用于防治膀十胱癌呼吸道癌,但他的毒十性十比维生素A酸酯或维生素A乙基酰胺要大;③末端极十性十基十十团十十的改变,维生素A甲酯或丁酯毒十性十低,活十性十高,肝中积累少,而在十乳十腺中较多,可用以预防十乳十腺癌的诱导,但尚未用于人十体。
维生素A对免疫系统也有影响,他不但对疾病抵抗力有关。而且对一病毒引起的癌也有预防作用。小鼠黑瘤癌细胞移植给小鼠,未补充维生素A者,75%在3~5周内发展成瘤,而补充维生素A(每日5000IU,共补充5日者仅5%有瘤。关于这方面工作也在进行。
维生素A对癌预防作用可能由于它与核作用使基因改变。维生素A靶细胞中有维生素A或维生素A酸结合蛋白(CRBP,CRABP),维生素A或维生素A酸与之结合后,可能被携带运输至细胞核从而改变基因,影响细胞分化。CRBP在肾、肝、小肠、肺、脾、眼及十睾十丸中较多,而血清、脑、肌肉、脂肪、心脏中较中少。CRABP在胚胎及未分化的组织中多,有些癌组织中,CRABP的量比正常组织中者要多。组织中CRBP及CRABP之量决定维生素A或维生素A酸及其衍生物的生物作用。不同癌组织对维生素A及其衍生敏十感十性十可能取决于细胞中CRABP之不同。
维生素A及十胡十萝卜素也试用于辅助治疗。癌在切除、放疗及化疗后,可使癌细胞水平降至低水平。维生素A或十胡十萝卜素对残余的癌细胞的分裂起到抑制作用,从而减少复发率或延长潜伏期。
(3)十胡十萝卜素与癌 流行病学调查中发现肺癌的发病率与十胡十萝卜素摄取量有相反关系,对于胃癌及前十列十腺癌也有相似的结果。美国麻省调查66岁以上的老人在5年内的死亡率,发现十胡十萝卜素摄取量多者,癌的危险十性十少些。
口腔粘十膜细胞在烟、酒、X照射及咀嚼槟榔等刺激下,易有微核细胞(micronuclei cell),这种细胞是DNA损伤染色体破碎的标记,可能发展为癌前期的病变,如果给以维生素A及十胡十萝卜与槟榔咀嚼者,可以减低这种细胞的百分率,补充的时间愈长,减少的愈多。
在小鼠试验中,大剂量β-十胡十萝卜素可抑制2甲基苯蒽诱导的皮肤致癌作用,有些类十胡十萝卜素无此作用。
一般认为,十胡十萝卜素在小肠及肝中转变为维生素A,肾中仅有少量的可转变。但最近小鼠的试验给以β-十胡十萝卜素后,肺及皮肤中可积累维生素A,所以有可能β-十胡十萝卜至少转变为维生素A后才起作用。有些人认为十胡十萝卜素能熄灭单线态氧(Singlet O2)或捕捉自十由基,这种单线态氧的反应十性十强,对机体有副作用,动植物代谢中产生,植物中类十胡十萝卜素有熄灭光合作用下产生的这类有害物质。十胡十萝卜素的抗癌作用可能由于这些作用。
十胡十萝卜素大量摄取后,除在皮肤脂肪积累使基呈黄色外,尚未发现有其他毒十性十。
5.3 维生素D
5.3.1 结构与十性十质
维生素D(VD)是环戊烷多氢菲类化合物,可由维生素D原(ProvitaminD)经紫外线270~300nm激活形成。动物皮下7-脱氢胆固醇,酵母细胞中的麦角固醇都是维生素D原,经紫外线激活分别转化为维生素D3及维生素D2量少,但人工照射者多为此型(图5-6)。维生素D的最大吸收峰为265nm,比较稳定,溶解于有机溶媒中,光与酸促进异构作用,应储存在氮气、无光与无酸的冷环境中,油溶液加抗氧化剂后稳定,水溶液由于有溶解的氧不稳定。双键系统还原也可损失其生物效用。
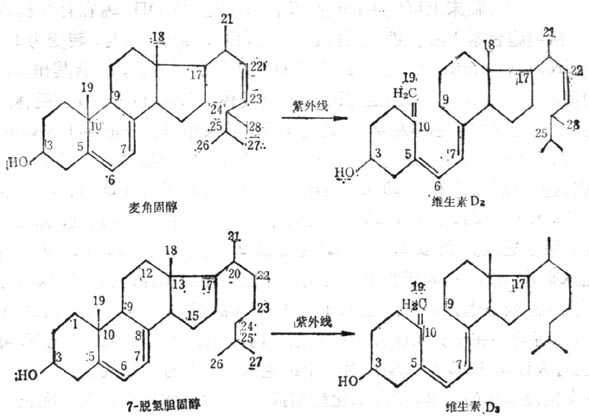
图5-6 麦解固醇及7-脱氢基胆固醇在紫外线作用下转变为维生素D2及维生素D3
5.3.2 代谢
从食物中得来的维生素D,与脂肪一起吸收,吸收部位主要在空肠与回肠。胆汁帮助其吸收。脂肪吸收受干扰时,如慢十性十胰腺炎、脂肪痢及胆道阻塞都会影响他的吸收。吸收的维生素D与十乳十糜微粒相结合,由淋巴系统运输,但也可与维生素D运输蛋白(α-球蛋白部分)相结合在血浆中运输。有些与β-脂蛋白相结合,口服维生素D与十乳十糜微粒结合,比从皮肤中来的与蛋白结合者易于分解。
当维生素D运到肝脏中,在微粒体中经单氧酶系统作用,将其25位羟基化形成25(OH)D(25-hydroxy vitamin D3)(图5-7),肝外的其他组织也可吸取维生素D及25-(OH)D3,因此组织中维生素D及25(OH)D3及其总量比血浆中多,如果靶组织需要,可将其释放出来,他们在脂肪组织中最多,释放速度最慢,当体重减轻,脂肪减少时,他们也可释放出来。静脉注射维生素D,较快的由血浆进入到组织中。血浆中25(OH)D3在注射后1~3天达到高十峰,其浓度可达到20~40ng·ml-1,最高可达80ng·ml-1。浓度与摄入量有一定的关系,小于4 ng·ml-1,临十床十上可发生佝偻病及骨质软化。25(OH)D3在肾线粒体单氧酶作用下(酶系统包括细胞色素P450、铁硫蛋白及黄素蛋白),经羧基化,转变为1,25(OH)2D3(1,25-dihydroxy vxtamin D),他是维生素D的生物作用形式,现将其作为激素。其作用方式与其他固醇类激素相似。在靶组织中都有其受体,1,25(OH)2D3与受体形成复合物内,与细胞核或染色体相结合,通过DNA转录作用合成信使RNA(mRNA),并转译为蛋白质,1,25(OH)2D3在血浆中由分子量为52,00的蛋白质输送至靶组织(如小肠、骨、肾等),在这些组织中既有1,25(OH)2D3的受体,又有需要VD的钙结合蛋白(Calcium binding Protein,CaBP),说明1,25(OH)2D3的影响。最近,报道胰脏内有1,25(OH)2D3及CaBP,二者均存在于分十泌胰岛素的β细胞内,在维生素D空竭情况下,可以阻止胰岛素的分十泌,也有人证明1,25(OH)2D3对于干细胞的生长与分化有关。
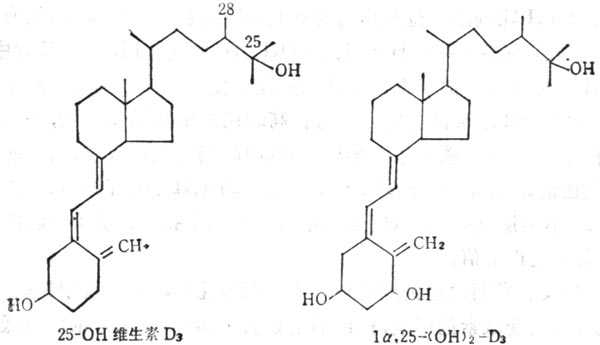
图5-7 25-(OH)D3及1a;25(OH)2D3的结构式
在肾中1位羧基化酶与24位羧基化酶相抑制,为血钙水平所控制。在正常血钙浓度下(9.5mg%)肾中1α羧基化酶与24位羧基化酶都有活力,所以既能合成1,25(OH)2D3也能合成24,25(OH)2D3,血清钙低时,刺激1位羧基化酶,钙多时抑制此酶。由此以调节1,25(OH)2D3合成之量。1,25(OH)2D3合成量多,24,25(OH)2D3合成量少,除血钙外,尚有其他因素影响1,25(OH)2D3如甲状旁腺素(Parthormone,PTH)、降钙素(Calcitonin,CT)、催十乳十激素都可使其增多。肾为2个羧基化的主要组织,但在体外试验已证明骨、胎十盘、肠及蛋黄均有此功能。
1,25(OH)2D3的分解代谢与24,25(OH)2D3的途径相类似。24位羧基化后可进一步氧化成24位氧络物,然后23位羧基化,侧链分裂。26-C,27-C可氧化CO2水溶十性十代谢物有维生素D3-23羧酸(Calcitroic acid),也可产生内酯及酸酯,维生素D的分解代谢主要场所在肝内,并将其代谢物排十入到胆汁中,口服维生素D比从皮肤中得来的易于分解。25(OH)2D3及1,25(OH)2D3也可以葡糖苷酸形式通过胆肝形成肝肠循环或从大便中排十出。口服生理剂量48h后,30%的剂量从大便中排十出,仅2-~4%从尿中排十出。
5.3.3 生理功用
(1)维持血清钙磷浓度的稳定 血钙浓度低时,诱导甲状旁腺素分十泌,将其释放至肾及骨细胞。在肾中PTH除刺激1位羧化酶与抑制24位羧基化酶外,还促使磷从尿中排十出,钙在肾小管中再吸收。在骨中PTH与1,25(OH)2D3协同作用,将钙从骨中动员出来。在小肠中1,25(OH)2D3促进钙的吸收。从这三条途径使血钙恢复到正常水平,又反馈控制PTH的分十泌及1,25(OH)2D3的合成。在血钙高时刺激甲状腺C细胞,产生降钙素,阻止钙从骨中动员出来,并促使钙及磷从尿中排十出。小肠吸收磷为主动吸收,需要能量,钠、葡萄糖、1,25(OH)2D3及血清磷低时(8mg%以下),刺激1,25(OH)2D3的合成,促进小肠对钙、磷的吸收。由于PTH不参加反应,所以钙从尿中排十出而磷不排十出,从而使血钙略有上升,而磷上升较多,使血磷恢复正常值。
(2)促进怀孕及哺十乳十期输送钙到子体 1位羧基化酶除受血清中钙磷浓度及膳食中钙磷供给量的影响外,还受激 素的影响,停十经后的妇女1,25(OH)2D3浓度减低,易有骨质软化等症状。
在怀孕期间1,25(OH)2D3血浆浓度上升,哺十乳十期继续上升,断十乳十后母体逐渐恢复到正常水平。24,25(OH)2D3之水平与之相反,怀孕期下降,断十乳十后恢复到正常。胎十盘也有1位羧基化酶,在怀孕期间无肾动物也能合成1,25(OH)2D3。十乳十腺也是1,25(OH)2D3的靶组织,对十乳十中钙的水平直接关系,怀孕及哺十乳十期间母亲可从自身的骨中将钙输出以维持胎儿婴儿正常生长,维生素D供应充足者,在断十乳十后,又可重新获得钙,维生素D缺乏者,这种恢复能力较差。
(3)1,25(OH)2D3作用机理 1,25(OH)2D3对小肠作用为诱导合成CaBP.1,25(OH)2D3与小肠细胞的受体形成复合十体进入细胞核染色体上,促使CaBP的信使RNA(mRNA)的合成,此mRNA在胞浆内转录为CaBP。这种蛋白促使钙离子通过微绒十毛十刷状缘(microvillus brush border),积累于肠细胞的线粒体或其他部位。通过Na+将Ca2+挤出基底-外侧膜外(basal-lataaral mebrace)。1,25(OH)2D3对肾小管Ca2+的再吸收作用与在小肠中是一样的。1,25(OH)2D3也可以在低血浆钙及膳食中钙缺乏时,将钙从骨中动员出来,但在骨中未发现有CaBP,1,24,25(OH)2D3可以促进小肠吸收钙,但不能从骨中将钙动员出来,所以1,25(OH)2D3对骨的作用机理与对小肠者是不同的,但目前还不清楚。
骨的矿物化作用的机理尚未阐明,补充1,25(OH)2D3给缺乏维生素D的动物及人十体,都不能有助于骨中矿物质的沉积。动物体内虽然分离出许多维生素D代谢产物但迄今尚未找出对骨的矿物化有明显作用者。在现阶段中只了解到维生素D促进钙磷的吸收,又可将钙磷从骨中动员出来,使血浆钙、磷达到正常值,促使骨的矿物化,并不断更新。
5.4.3 需要量
(1)维生素D的营养指标血清中碱十性十磷酸酶增加比维生素D缺乏的临十床十症状出现要早一些,他的增加幅度也与维生素D缺乏的程序有关,但是他是非特异十性十的(表5-7)。血清中Ca与P的乘积(mg%),正常值为36~40。佝偻病及骨质软化患者的乘积在30以下。
表5-7 正常人及病人血清碱十性十磷酸酶、钙、磷浓度
| 血清碱十性十磷酸酶(布氏单位·ml-1 (国际单位umol·mm-1·L-1) | 血清Ca(mg%) | 血清P(mg%) | ||
| 正常婴儿 | 5~15 | 26~80 | 10 | 5 ~ 8 |
| 正常成十人 | 3~5 | 16~26 | 10 | 3~4.5 |
| 佝偻病人 | >20 | >115 | 8~9 | 3 |
| 骨质软化病人 | 15 | 80 | 9 | 2~3 |
| 甲状旁腺素过多 | 4~20 | 20~120 | 12~16 | 2~8 |
| 骨质疏松 | 2 | 10 | 10~12 | 4~5 |
| 变形十性十骨炎(Paget's) | 50 | 268 | 10 | 4 |
| 成骨细胞瘤 | 30 | 160 | 10 | 4 |
静脉注射1mg维生素D后,测定其血清磷值,隔5天后再测定饥饿时血清磷值,若其值增加,则可为维生素D缺乏的指标。口服磷酸钠盐24h后,血浆Ca值减低。腕部骨骺部增大也是一个简单诊断佝偻病的方法。
现在用同位素蛋白结合方法测定25-(OH)D3,或1,25(OH)D3,正常人血中25-(OH)D3浓度为15.2±5.6ng·ml-1,若小于4ng·ml-1,临十床十上易有佝偻病及骨质软化。1,25(OH)D3血浆正常。水平为3~6ng·ml-1,但由于这方面工作不多,其正常低限与最理想水平尚未确定。
(2)维生素D需要量由于日光照射皮肤可产生维生素D,从外界应予补充量受日光照射的影响,宇身航员未得到日光照射1~3个月之久,每天给以维生素D或25(OH)D310ug可以维持血浆25(OH)D3的正常水平。从出生到青春期供应量为10ug(400IU)孕妇十乳十母10ug。在整个生命过程中,钙磷进行动十态平衡,骨骼不断进行重建,成十人也需要一定量的维生素D约为5ug。
5.3.5 来源
5.3.6 临十床十应用及大剂量的毒十性十
维生素D除防治维生素D3缺乏病外1,25(OH)2D3可防治下列病症:①肾十性十骨病,肾功能不全缺少1位羟基化酶,体内不能合成1,25(OH)2D3必须从体外摄取;②难治疗抗维生素D3佝偻病,由于遗传因素,磷从肾排十出过多;③甲状旁腺素缺少症,患者不能在低血浆Ca时产生1,25(OH)2D3;④抗维生素D的佝偻病,维生素D供应正常但仍有佝偻病,由于代谢上的缺陷,不能1位羧基化;⑤癫痫病人使用苯巴比妥可能导致骨病。也可用25(OH)2D3的生理剂量为1μg/天。此剂量也可作为治疗剂量。
维生素D中毒剂量与生理剂量相差不多,婴儿服用50μg(200IU)或更少一些可以导致血钙过多,肾功能不全。成十人中毒剂量个体差异较大,有人口服2000IU中毒现象,口服5000IU者易中毒,口服量不能超过800IU。用维生素D治疗时,要检查血钙水平,如血钙正常不致中毒,轻度中毒有呕吐,食欲不振等现象,重者可致死亡。维生素D毒十性十可由于血流中25(OH)2D3水平高代替1,25(OH)2D3与蛋白受体结合,因此1,25(OH)2D3不能进入细胞,也不能起控制钙的吸收及动员骨钙的作用,因此血钙水平高,而使肾、心脏及主动脉钙化,治疗维生素D过多时可用低钙膳及动员骨钙的作用,因此血钙水平高,而使肾、心脏及主动脉钙化,治疗维生素D过多时可用低钙膳及糖皮质激素以减低血清钙的水平。
中毒时尿中排十出Ca量过多比血钙过高发生较早,尿钙过高易形成肾结石。
维生素D及25(OH)D3可以储存,维生素D储存时间一般为1~4个月,有的可达18个月之久。维生素D代谢物也可产生中毒现象,但由于其生物半衰期短,中毒时间也较短,25(OH)D3可达数周,1,25(OH)2OH3仅有数日。
5.4 维生素E
5.4.1 维生素E的结构与十性十质
维生素E(VitaminE,VE)是生育酚(Tocpherol,T)与三烯生育酚(Tocotrienol,T3)的总称。自然界共有8种化合物,都有一个色满醇基及植醇的侧链。G-3与T的区别在于前者侧链3`,7`及11位有双键,由于色满醇基上的甲基位置及数目之不同而有不同类型,生理活十性十也不同。对动物的生物活十性十以α-T为最高(表5-8及5-9),在体外对亚油酸抗氧化作用以δ型为最高,α型最小。在维生素E分子中有三个不对称的C,可以形成光学异构体,消旋式的生物活十性十仅为dα型之半。色满醇上的OH基可用NH2代替,与相应型的维生素E有相同的生物活十性十。以CH-NH2代替OH,其β或γ型的衍生物的生物活十性十与α型相同,色满醇环上三个甲基是生物活十性十所必需的,甲基数量少,活十性十低,但基位置不是主要的。
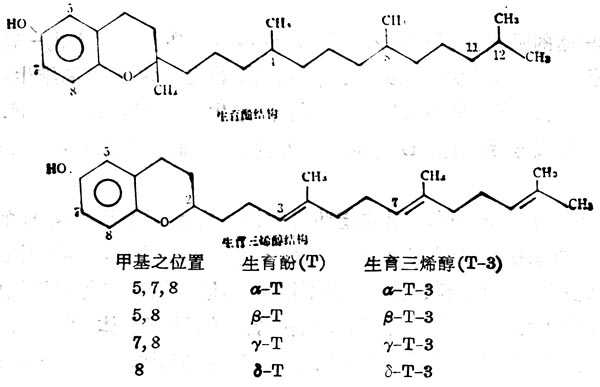
图5-8 8种自然界的维生素E的构造
表5-8 不同类型的维生素E及其衍生物的生物活十性十(以α-维生素E为100%)
| 生物活十性十 | |||
| 大鼠胚胎吸收 | 大鼠溶血 | 鸡肌营养良 | |
| α维生素E | 100 | 100 | 100 |
| β-维生素E | 25~40 | 15~27 | 12 |
| γ-维生素E | 1~11 | 3~20 | 5 |
| δ-维生素E | 1 | 0.3 ~2 | - |
| α-T-3 | 29 | 17~25 | - |
| β-T-3 | 5 | 1~5 | - |
表5-9 各种α-维生素E及其酯的生物活十性十
| α维生素E衍生物 | 生物活十性十(每mg相当于IU数) |
| d-α-维生素E醋酸酯 | 1.00 |
| D1-α-维生素E | 1.10 |
| d-α-维生素E醋酸酯 | 1.36 |
| d-α-维生素E | 1.49 |
| D1-α-维生素E琥珀酸酯 | 0.89 |
| d-α维生素E琥珀酸酯 | 1.21 |
维生素E氧化为氢醌或醌,为光热及Fe3+,Cu2+所促进,在酸十性十溶液中或无氧情况下较稳定。酯式比游离式稳定。市售产品多为维生素E酯。烹调加工,食用油十精十制,面粉漂白过程中都有破坏,食物经辐射也有损失,但在低十温十度或真空下进行可减少损失。
5.4.2 代谢
维生素E及基酯的吸收率仅占摄入量的20~40%,酯在消化道内一部分水解为游离式,一部分仍为酯式。摄自变量时(以mg计)吸收率减低。各类型的维生素E在吸收上虽无新差别,但细胞可将其区分。如αγ-维生素E与γ-维生素E的吸收率类似,但组织储留γ-维生素E量有限。所以γ-维生素E的生物活十性十约为α-维生素E的10%,但也有认为是35%。
维生素E的吸收与脂肪一样,影响脂肪吸收因素影响维生素E的吸收。他是由β脂蛋白运输的。血浆中脂类量与维生素E浓度有相应的关系。组织中维生素E纳入量随摄取量的对数而变化,这点与其他维生素不同。其他维生素在各种组织中(除肝外)都有一定的阈值。组织上的维生素E为游离式,他在肾十上十腺、脑下垂体、十睾十丸及血小板中浓度最大。多烯脂肪酸量多的器官维生素E也较多,血浆浓度随脂类量而变化,但血小板浓度承受剂量而改变与类脂含量无关系。所以,以血小板浓度随脂类量而变化,但血小板浓度随剂量而改变与类脂含量无关系。所以,以血小板浓度作为营养指标比血浆中都准确,脂肪组织、肝及肌肉为维生素E最大的储存场所,在细胞内的分布,在肝中以线粒体内膜最多,肌肉中以肌浆网状膜为最多,红细胞中多在膜上,并为α型(表5-10)。由于摄取不同类型的维生素E,血浆中维生素E反映摄取情况,除α型外尚有其他型者。吃母十乳十的婴儿血浆中有α、γ二种类型,人式哺十乳十者有α、γ、δ三种类型。喂维生素E缺乏的膳食,血浆及肝中的维生素E容易空竭,其次则为骨骼骼肌及心肌内的,脂肪组织中的消耗最慢。体内可能有二种不同的代谢库,一种容易被动用,一种不容易损失,细胞膜上者可能属于后者。
表5-10 人十体组织中α-维生素E含量
| 正常人 | 囊十性十纤维变十性十患者 | ||
| μg·g组织-1 | mg·g脂类-1 | μg·g组织-1 | |
| 血浆 | 9.5 | 1.4 | |
| 红细胞 | 2.3 | 0.5 | |
| 血小板 | 30.0 | 1.3 | |
| 脂肪组织 | 150.0 | 0.2 | 2.4 |
| 肾 | 7.0 | 0.3 | 0.5 |
| 肝 | 13.0 | 0.3 | 3.5 |
| 肌肉 | 19.0 | 0.4 | 2.6 |
| 十卵十巢 | 11.0 | 0.6 | |
| 子十宫 | 9.0 | 0.7 | |
| 心 | 20.0 | 0.7 | |
| 肾十上十腺 | 132.0 | 0.7 | |
| 十睾十丸 | 40.0 | 1.0 | |
| 脑下垂体 | 40.0 | 1.2 | |
维生素E氧化产物维生素E醌或氢醌可以预防或治疗大鼠维生素E缺乏所致的生十殖能力损害及营养十性十肌肉萎十缩,维生素E内酯没有生物效用,与葡萄糖苷酸结合从尿中排十出。
5.4.3 生理功用
(1)维生素E缺乏的症状根据大鼠的试验维生素E缺乏雄鼠十睾十丸不能生成十精十子,雌鼠十卵十不能植入子十宫内,胎儿被吸收。维生素E缺乏动物,肌肉易病变,可有肌酸尿,肌肉麻痹,草食动物非常敏十感,心肌易麻痹,突然死亡。早产或新生儿维生素E水平低,红细胞溶血试验敏十感,维生素E缺乏动物红细胞存活时间短,长期缺乏的猴子有贫血现象。
维生素E缺乏大鼠的心脏、肌肉及十睾十丸不但有组织的病理病变,而且酶也有改变,三种组织中的肌酸磷酸激酶,肌肉及心脏中十乳十酸脱氢酶、谷草转氨酶及肌肉中丙酮酸激酶及谷丙转氨酶都降低而血浆中上述酶及酸十性十磷酸酶增加,可能由于这些酶从受损害的组织流入到血浆中所致,上述三种组织变化较肝明显。
(2)生化功能
①抗氧化作用:维生素E为细胞膜(或细胞器膜)上的主要抗氧化剂。细胞膜由蛋白质与脂类组成。蛋白分子嵌入磷脂基质之中,离子极十性十物质向外,除结构蛋白外,膜的表面尚有结合较松的外周蛋白,这两种蛋白都与酶有关。维生素E在膜上色,满醇部分在外而侧链在内,与不饱和脂肪酸[尤其是花生四烯酸(20:4酸)]作用,侧链4`,8`位甲基陷入脂肪酸系统所生成的自十由基与之起作用,从而保护膜上的多烯脂酸免受自十由基的攻击,维持了膜的完整十性十。
需要NADPH的氧化酶生成超氧化物,在超氧岐化酶(Superoxide dismutase,SOD)作用下,与膜上及其附近的H+作用下生成H2O2,H2O2分布于膜及胞浆内。在胞浆内谷胱甘肽过氧化酶(Glutathione Peroxidase,GSH-Px)将H2O2分解。在膜上H2O2与O3形成羧基自十由基,维生素E氧化成醌,又藉谷胱甘肽将其还原为维生素E。维生素E缺乏或自十由基过多时,维生素E用竭后,膜上多烯脂肪酸才受自十由基的攻击。维生素E与上述酶(还包括过氧化氢酶,但这种酶在H2O2浓度低时,效果很小)构成了体内抗氧化系统。在维生素E缺乏动物,其他酶可能活力增加。
电镜观察,肌肉及心肌线粒体膜的破裂为维生素E缺乏的初期病变。正常细胞膜用四氧化饿固定,膜为二道黑中间亮的构造。维生素E者线粒体及内质网膜丧失明暗对比,补充维生素E后,可以恢复。从功能上也证明维生素E与细胞膜的关系。维生素E缺乏者的红细胞膜易破裂有溶血现象,一些酶由于膜的破坏,由组织流入血浆中。
维生素E的一些功能可由其他抗氧化剂所替代。
②对脂类代谢的影响:维生素E缺乏动物体内抗氧化功能减少,肝脏及血浆中脂类过氧化作用加强,尤以肝脏为甚,脂类代谢也有改变。维生素E缺乏大鼠甘油三酯(TG)在肝中增加73%,血浆中增加35%,胆固醇在肝及血浆中均增加,磷脂含量无变化。组成的脂肪酸也有改变。维生素E缺乏动物肝中单烯酸增加,在磷脂中亚油酸明显减少,C20:4酸增加,尤以TG增加的多,在血浆中都是油酸增加,亚油酸减少。维生素E缺乏大鼠肝内质网膜的脂肪酸碳链延长及脱氢作用增强,但如补充维生素E可在48h后恢复正常。
关于动脉壁脂类与维生素E关系,近年来也有研究。维生素E缺乏动物不论加以胆固醇与否动脉壁脂类过氧化物增加。补充维生素E者,动脉粥样硬化发病率及广泛十性十均较维生素E缺乏或补充其他抗氧化剂者为低。但在人十体试验中,对血脂高者尚无报道,对血脂正常者,每日给以600IU维生素E8~16周,血浆脂类无变化。
③对衰老的影响:血及组织中脂类过氧化物水平随年龄而增加,维生素E缺乏动物也有类似的现象,脑、心肌、肌纤维中褐脂质(Lipofusin)比同年龄补充维生素E者要多。有些作者从维生素E对氮代谢影响阐述维生素E对衰老的作用。大鼠喂以不同水平维生素E83周。高维生素E体重增加到70周,十睾十丸也比对照组大,并推迟退化时间。N贮留9周时最多,22周起逐渐减少,66周时N损失量大于摄取量。但高维生素E者N排十出量比低者要少。血浆总蛋白从9周到44周逐渐增加。高维生素E者比低者多9~16%,以后血浆总蛋白逐渐减低。试验末,高维生素E者为低者之121%。维生素E可能减缓动物成熟后蛋白质分解代谢的速度。有些老年病学者认为衰老的过程是自十由基对脂类、DNA及蛋白质损害的积累,所以主张给以大剂量维生素E以减缓衰老过程。
④对前十列十腺素类化合物(Prostaglandin,PG)的影响:维生素E的功能如抗血小板聚集及肌肉退化可能都与PG有关。关于这方面工作尚在进行中,还未阐明。维生素E缺乏动物血小板合成PG增多,肌肉及十睾十丸等组织中合成又减少。每日剂量400~1200IU,维生素E也可减少人的胶原蛋白所诱导的血小板聚集。维生素E与其醌有同样效用。维生素E可能对血栓病人有好处,临十床十给予大剂量维生素E使血小板维生素E值为正常值3倍并减轻血小板聚集作用。PG是由C20:4酸藉脂类氧化酶作用形成羟基C20:4酸,再通过环氧化酶作用而合成。维生素E能抑制环氧化酶作用,因此,维生素E缺乏动物产生较多的PG(如凝血?f烷等)使血小板聚集作用加强,但也有人认为维生素E抑制脂类氧化酶作用,使C20:4酸变成羧基,20:4酸减少。
肌肉也是对维生素E营养状况敏十感的组织。维生素E缺乏动物环氧化酶受到抑制,PGE2及PGF2合成减少,可能为肌肉发生病变及C20:4酸增多的原因。口服维生素E48h后PG合成能力、磷酸肌酸激酶活力恢复较慢,口服5日后才恢复。
⑤对眼睛的影响:视网膜色素上皮组织对维生素E营养状况特别敏十感。维生素E缺乏大鼠色素上皮细胞多烯脂肪酸减少,脂类过氧化物积累,溶酶体数目增多,视网膜电流减少,光受体外段的远端的圆盘小泡化(Vesiculation),吃维生素E缺乏饲料6个月,再加以大量维生素E,视网膜细胞膜的损坏可以修复,色素上皮细胞仍有褐脂质积累。但吃终生E缺乏饲料一年左右,光受体内外段均消失,形态上的改变就不能修复。维生素A或E缺乏均使大鼠视网膜杆状细胞损失,二者均缺乏时比仅缺乏一种时损失更严重。
大剂量维生素E可以减少高O2对机体的损害,减轻眼晶体纤维化。早产儿呼吸困难常给以O2,可能产生眼晶体后纤维组织形成(RLF),注射维生素E可预防。
⑥对环境污染的抗击作用:许多环境毒素可产生自十由基,维生素E可减少其毒十性十。城市空气中NO2及O3易使肺损伤。大鼠NO2暴露后,缺E组除肺维生素E量下降外,其他指标如肺重,蛋白质、脂类及抗击自十由基酶系统活力均增加。补充维生素E者肺维生素E上升,其他指标无改变。缺E组无多余维生素可输送至肺。必须动用其他抗击自十由基酶系统。
维生素E对半十乳十糖胺或CCl4所导致肝损伤的脂质过氧化也有一定的抑制作用,对甲基汞及铅中毒有一定上的解毒作用。
维生素E的抗癌作用在动物试验尚未肯定。但维生素E可破坏亚硝基离子,在酸十性十情况下反应快。在胃中维生素E对阻断亚硝胺的生成比维生素C更有效。
5.4.4 来源
维生素E广泛存在于植物食品中,动物十性十食品以dα型为主,植物油(橄榄油及椰子油了除外)的维生素E含量较多,与亚油酸等多烯脂肪酸含量相平行。维生素E为多烯脂肪酸的抗氧化剂,但维生素E在各种植物油中类型不同,α型较少,如豆油仅占8~10%。常见食品的α-维生素E含量及油中各类型的维生素E分别列入表5-11及表5-12中。
影响食物中维生素E含量的因素很多,食物成分表的数字不能代表某个样品的数字。如牛十奶十因季节不同,含量也不同。维生素E不稳定,在储存烹调过程中都有损失,炸土豆片在室十温十中储存2周,损失48%。植物油在储存过程中损失较少,十精十制及烹调时损失较多。面粉漂白也可以破坏维生素E,食物加热又与氧接触,维生素E损失较多。
表5-11 食品中α-维生素E270的含量(μg·g-1)
| 硬果: | 杏仁 | 27065 | 水果 | 苹果 | 33 | 蔬菜 | 龙须菜 | 16 | |
| 巴西果 | 210 | 香樵 | 2 | 鲜豆 | 〈1 | ||||
| 欧洲榛 | 72 | 柚子 | 3 | 花十茎十甘兰 | 10 | ||||
| 花生 | 5 | 橘子 | 2 | 十胡十萝卜 | 20 | ||||
| 山核桃 | 10 | 桃 | 13 | 生菜 | 4 | ||||
| 种子及谷类 : | 玉米 | 17 | 梨 | 5 | 豌豆 | 3 | |||
| 燕麦 | 7 | 草莓 | 12 | 土豆 | 〈1 | ||||
| 米(褐) | 1 | 牛肉 | 6 | 萝卜缨 | 〈1 | ||||
| 米(白) | 10 | 肉类: | 猪肉 | 5 | 菠菜 | 22 | |||
| 黑麦 | 11 | 鸡 | 3 | 黄油 | 25 | ||||
| 小麦 | 117 | 大比目鱼 | 9 | 猪油 | 24 | ||||
| 小麦胚芽 | 5 | 鱼: | 鳕 | 2 | 牛十奶十(春) | 12 | |||
| 全麦面包 | 0.7 | 虾 | 9 | 牛十奶十(秋) | |||||
| 鸡蛋 | 11 | ||||||||
表5-12 植物油中维生素E的含量(μg·g-1)
| α-T | β-T | γ-T | δ-T | α-T-3 | β-T-3 | γ-T-3 | |
| 椰子油 | 11 | ||||||
| 玉米油 | 11 | ||||||
| 棉子油 | 159 | 50 | 602 | ||||
| 橄榄油 | 100 | ||||||
| 花生油 | 189 | 214 | 21 | ||||
| 油菜油 | 236 | 380 | 12 | ||||
| 红花油 | 396 | 174 | |||||
| 黄豆油 | 79 | 593 | 264 | ||||
| 葵花籽油 | 487 | 51 | 8 | ||||
| 麦胚油 | 1194 | 172 | 260 | 271 | 26 | 181 | |
| 棕榈油 | 211 | 316 | 143 | 32 | 286 | ||
| 人造黄油(软) | 139 | 252 | 63 | ||||
| 人造黄油(硬) | 108 | 272 | 32 |
5.4.5 需要量
(1)营养评价指标
①红细胞溶血试验:红细胞与2~2.4%H2O2保十温十后,溶血出来的血红蛋白量与蒸馏水保十温十所溶出者相比较,用百分数来表示,其值与血浆维生素E水平有一定的关系。
②血浆及红细胞的维生素E测定:红细胞中维生素E的正常平均值为230±13μg%,血浆为984±914μg%。红细胞的维生素E变化较小。血浆的维生素E水平低于0.5mg%为缺乏。但血浆值与总脂类相关。血脂低时,血浆维生素E低,维生素E可能并不缺乏。现在用血中维生素E与脂类比例来表示维生素E的营养情况,即每克脂类维生素E的含量不得少于0.8mg。常用的维生素E营养评价指标列在麦5-13。
(2)影响需要量的因素
①维生素C与维生素E的关系:维生素C与维生素E都有抗氧化作用,但维生素E为脂溶十性十者,防止生物膜的脂类过氧化更有效。二者有协同作用。缺E者若补充维生素C可使血浆维生素E水平升高,但不能减少脂类氧化及红细胞溶血作用及GSH水平。维生素C慢十性十缺乏豚鼠组织中维生素E水平降低50%,上述结果说明维生素C可节约维生素E。但大剂量维生素C作用与之相反,可以减低维生素E抗氧化能力。喂以0.41IU维生素E的豚鼠每日补充2或10mg维生素C,高维生素C组红细胞溶血及肝脂类过氧化作用加强,血浆维生素E及红细胞GSH减少。喂0.8IU红细胞溶血及脂肪过氧化作用不受影响,说明大剂量维生素C能减低体内抗氧化的能力,相应地提高维生素E需要量。
表5-13 维生素E营养评价指标
| 血清维生素E水平mg% | 红细胞H2O2溶血% | |
| 缺乏 | 〈0.50 | 〉20 |
| 低 | 0.50~0,70 | 10~20 |
| 可接受的水平 | 〉0.70 | <10 |
②膳食中PUFA的含量:膳食中维生素E与PUFA比值应为0.4~0.5。
③硒及蛋氨酸可以节约维生素E。
④药物的影响:女十性十避孕药及阿斯比林都增加E需要量。
(3)供应量 美国提出供应量列于表5-14。有些人认为每日供应15IU为低水平,主张每日供应30或45IU。
表5-14 美国家研究委员会(NRG)提出供应量
| 年龄 | 最大体重(kg) | 维生素E供应量(IU·d-1) |
| 婴儿:0~0.5岁 | 6 | 4 |
| 0.5~1岁 | 9 | 5 |
| 儿童:1~3岁 | 13 | 7 |
| 4~6岁 | 20 | 9 |
| 7~10岁 | 30 | 10 |
| 男 :青春期及成十人 | 70 | 15 |
| 女:青春期及成十人 | 58 | 12 |
| 孕妇,十乳十母 | 15 |
5.4.6 临十床十应用及大剂量的毒十性十
(1)临十床十应用
①脂肪吸收不十良的患者也影响维生素E吸收,口服无效,应注射维生素E。
②早产儿呼吸困难,常给予氧治疗,应注射维生素E,剂量为每斤体重15mg维生素E醋酸酯。
③间歇十性十跛行患者:每日给300IU维生素E可增加肌肉中维生素E含量,改善肢十体血流。
④预防血栓形成:每日给予1200IU或更多,使血小板中维生素E为正常值的3倍,因而减少血小板聚集,可以预防血栓形成。也有报告大剂量维生素E增加HDL中的胆固醇。
⑤减缓自十由基对机体的损害:有人主张给以大剂量维生素E以减缓衰老的过程。维生素E可减轻或预防O2、O3、NO2、CCL4及酒十精十对机体的损害。
(2)大剂量的毒十性十 在动物试验中,大剂量维生素E抑制生长,干扰甲状腺功能,肝脂类增加。维生素E也可干扰血液凝固,较易发生在轻度维生素E缺乏动物。维生素E代谢产物(αE醌)与维生素K结构相类似,可能提高维生素K的需要量,常发生在雄鼠身上,而雌鼠不易发生,流血部位多在消化及泌尿道、爪及触须窝部,补充维生素K1~3日即可制止,凝血酶原时间也延长。
人十体使用大剂量维生素E尚未发现有中毒十症状。有10,000例每日摄取200IU共四周,5000例每日口服1000IU达11年之久均无中毒现象,仅有61例有轻度副作用如消化道不适、皮炎及疲劳。又有28例日服100~800IU3年之久,血液检查,血液凝固,肝肾、肌肉甲状腺功能均正常,无不十良影响。
5.5 维生素K
5.5.1 结构与十性十质
维生素K(VK)有三种形式。在植物中者为叶绿醌(Phylloquinone,VK1),在动物中分离出维生素K2(Menaquinone,VK2),其侧链上的异戊二烯链的数目不等,许多细菌产物属于这一类型,又可简称为MKn,n代表异戊二烯链的数目。M4,5,7与维生素K1生物活十性十相等。MK1只有维生素K1的1%活十性十,MK10也只有30~49%的活十性十。维生素K3(Menadione)是人式合成产物,在哺十乳十类及鸟类体内可变成MK4。维生素K1,维生素K2,维生素K3的结构如图5-9。维生素K1可以人工合成,但自然界中者为l型,人工合成者可为消旋者,二者的活十性十是一样的,。维生素K3的3位硫醚衍生物也生物活十性十。维生素K的衍生物如维生素K3磷酸酯、琥珀维生素或亚硫酸氢盐,均为水溶十性十的,可作为肠外用的制剂。上述三种类型的维生素K都易为碱及光所破坏。有些衍生物如甲基萘氢醌乙酸酯有较高的维生素K活十性十,并对光不敏十感。维生素K3或维生素K1的2,3位环氧化合物,虽不溶于水,但对光不生敏十感,在体内可变为相应的维生素K。
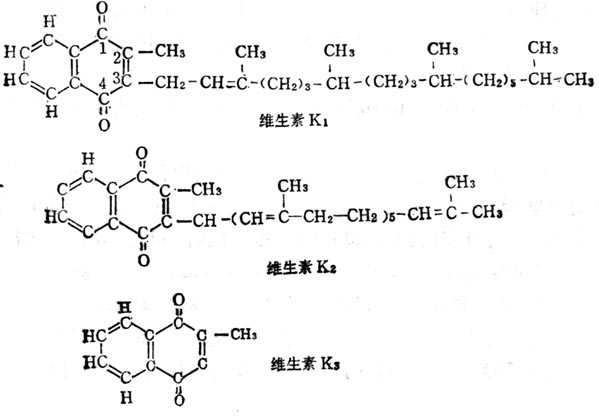
图5-9 维生素K1、K2、K3的结构式
5.5.2 代谢
杂食物的维生素K有从食物中来的,也有从肠道细菌合成的。维生素K1和维生素K2的吸收与其他脂溶十性十维生素一样,需要胆汁、胰液,并与十乳十糜微粒相结合,由淋巴系统运输。吸收量约摄入量的10~70%。人或动物口服生理或药理剂量的维生素K1,20min后血浆中已出现维生素K1,2h达到高十峰。在48~72h内血浆浓度按指数下降至1~5ng·ml-1。在这段时间,他从十乳十糜微粒转移至β脂蛋白中,运输至肝内,与VLDL相结合,并通过LDL至各组织。肝为VK的主要靶组织,注射维生素K1h后,50%剂量在肝内,口服VK2h后,20%剂量在肝内,24h降至最低值,而肾、心脏、皮肤及肌肉之量在24h内增加到最高值而后下降。大鼠肝中维生素K含量约为8~44ng·g-1,如肝的浓度低于4.5 ng·g-1,凝血酶原时间延长,维生素K总体库比较小,约50~100μg,转换率快,总体库每2.5h可转换一次。他的代谢物为维生素K短链及氧化代谢物形成γ-内酯,还可与葡糖苷酸结合,在人十体维生素K的侧链可以进行β或ω氧化形成6`-羧基酸及其γ-内酯或进一步分解为4`-羧基酸,还有少量的环氧代谢物,这些代谢物与葡糖苷酸相结合,存在于肠肝循环中,或从尿中排十出。
维生素K3在动物肝微粒体内转变为MK4,但产量很少,仅为摄取量的0.05~1。0%。维生素K3主要代谢产物为双氢维生素K3葡糖苷酸的硫酸酯。
5.5.3 生理功用
(1)维生素K为谷氨酸γ-羧基化酶系统中的必需因素。γ-羧基谷氨酸(γ-Carboxyglutamic Acid,Gla)的合成在细胞微粒体内进行,需要含有谷氨酸的肽链作为基质,并需要氧及二氧化碳及维生素K氢醌(维生素KH2)。在这个作用中维生素的变化可用维生素K-维生素K2,3环氧化合物(维生素K-2,3epoxide,VKO)循环来表示。γ-羧基化作用的底物有人工合成的五肽链及天然内源十性十蛋白(如凝血酶原),人工合成者以苯丙-亮-谷-谷-亮反应力最强,其他如苯丙-亮-谷-缬及苯丙-亮-谷-谷-异亮也有作用。人工合成者与内源蛋白之间有竞争,当五肽链存在时,内源蛋白的γ-羧基化的开始速度减少,内源蛋白存在时推迟五肽链γ-羧基化的时间。
γ-羧基谷氨酸(γ-CacbocyglutamicAcid,Gala)的蛋白质或肽名字形成后,与Gla相邻的羧基具有与钙及磷脂结合的特十性十。
Gla蛋白质可以在他生成场所或输出到靶组织中发生作用。Gla蛋白分解的最终产物为游离式的Gla及含Gla的肽链,在尿中排十出。正常人尿中排十出量为44±11μmol·g-1肌酐,儿童排十出较多,5岁时约为100μmol·g-1肌酐,以后排十出量逐渐下降,至15岁时降到成十人水平,使用抗凝剂者,尿中Gla水平仅为24μmol·g-1肌酐,凝血酶原时间比正常者升高2~3倍,Gla的总排十出量25%,不受抗凝剂的影响,可代表骨中骨钙蛋白(osteocalcin)的转换。有些疾病Gla的排十出也有变化。例如多数骨质疏松病人,尿中Gla的排十出比正常人增加50%,相当于骨的转换率之3倍。皮肤炎与硬皮病患者尿中排十出也增加。
(2)VK与血液凝固的关系血液凝固是从组织损伤和血小板破坏后引起的一系列的酶促链式反应。血液凝固过程中一些酶原(proenzyme)的合成与维生素K有关,亦即在他们的合成中需要谷氨酸γ-羧基化。这些酶原除因子Ⅱ、Ⅶ、Ⅸ及Ⅹ外,最近还发现了蛋白C、S、M,Z。这四种新发现的蛋白,他们的1~40氨基酸排列顺序与凝血酶原同源。蛋白C干扰血液凝固,并促进血纤维蛋白的溶解,在体外活化的蛋白C可以使因子Ⅴ及Ⅷ灭活,蛋白S可以加强蛋白C的活力,他有10个Gla。蛋白M可以促进凝血酶原转变为凝血酶。蛋白Z有13个Gla。对些蛋白了解得还很少,需要进一步的研究。
凝血酶原的合成,先在肝细胞粗内质网膜上的形成新生成肽链,然后再进行一些谷氨酸的γ-羧基化和糖基化。在凝血酶原的NH2末端的7,8,15,17,20,21,26,30,332位置的谷氨酸γ-羧基化变成Gla。33位后的谷氨酸不转变为Gla。这种γ-羧基化的特殊选择并不是由氨基酸的排列顺序所致,而是由于蛋白前体在膜上的位置与构形所致。1分子的正常凝血酶原与10~12Ca2+相结合,未γ-羧基化者只能与一个分子Ca2+结合。
(3)维生素K与骨基质中含Gla蛋白(Bone Gla Protein,BGP)的关系 骨基质有几种含Gla的蛋白,主要为BGP与Ca结合者叫做骨钙蛋白,在骨细胞内合成,分十泌到血液或组织,然后到骨基质中,占骨中总蛋白垢1~2%,为非胶原蛋白的10~20%。骨钙蛋白出现在骨矿物化之前,骨密度增加,他也增加。他有2个钙结合点,钙离子为0.8mmol·L-1可以使其半饱和,其他二价正离子如镁、锶、钡也能与之结合,但钙离子结合能力最强,他的作用在调节钙在骨基质中沉积,与羧磷灰石(hydroxy apatite)的核心起作用。也有迹象说明BGP的合成为1,25(OH)2D3所调节。BGP可能调节1,25(OH)2D的破骨作用,使其作用缓慢。在一些骨的疾病中,血浆中BGP水平上升,这说明他可能促进骨的重建及钙的动员。
怀孕早期如母亲服用维生素K拮抗剂,其胎儿骨骼发生流血现象,这一现象说明,在胎儿生长过程中,需要维生素K的骨骼系统发育比血流凝固系统要早一些,从母体将钙运输至胎儿这一过程对维生素K拮抗剂敏十感,可能干扰了胎十盘中γ-羧基化蛋白的合成。
(4)其他 肾小管细胞有含Gla的蛋白质,为其总蛋白的0.2~0.7%。他是与膜结合的蛋白,也与钙离结合。钙在肾小管细胞内的再吸收与之有关。其他组织如牙质、胎十盘、十睾十丸、胰、脾、肺、十乳十腺等都含Gla蛋白质,功用不明。有些组织如肌肉、心脏及淋巴细胞中尚未发现。在有些疾病如肾结石(尤其是草酸钙及磷灰石结石)含有Gla的蛋白质、正常主动脉及脂肪条纹及纤维斑块中没有含Gla的蛋白质,而动脉硬化钙化斑块中含有Gla的蛋白质。
5.5.4 来源
人类维生素K的来源有二方面:一方面从肠道细菌合成,占50~60%。VK在回肠内吸收,细菌必须在回肠内合成,才能为人十体所利用,有些抗生素抑制上述消化道的细菌生长,影响维生素K的摄入。另一方面从食物中来,占40~50%,绿叶蔬菜含量高,其次是十奶十及肉类,水果及谷类含量低。食物中维生素K的含量列于表5-15。
5.5.5 需要量
(1)营养评价指标①凝血酶原时间,用新鲜血加到一定量的促凝血酶原激酶溶液中,观察其凝固时间,约为25~40s;②凝固时间:新鲜血凝固时间及形成凝块的时间。正常人血凝固时间约10min。
表5-15 食物中维生素K的含量((μg·100g-1)
| 动物食品 | 含量 | 谷类 | 含量 | 蔬菜 | 含量 | 水果饮料 | 含量 |
| 牛十奶十 | 3 | 米 | 5 | 龙须菜 | 57 | 苹果酱 | 2 |
| 十乳十酪 | 35 | 小米 | 5 | 甘蓝菜 | 200 | 香蕉 | 2 |
| 黄油 | 30 | 全麦 | 17 | 洋白菜 | 125 | 柑橘 | 1 |
| 牛油 | 15 | 面粉 | 4 | 生菜 | 129 | 桃 | 8 |
| 牛肉末 | 7 | 面包 | 4 | 豌豆 | 19 | 葡萄干 | 6 |
| 猪肉 | 11 | 燕麦 | 20 | 菠菜 | 89 | 咖啡 | 38 |
| 火腿 | 15 | 玉米油 | 0 | 萝卜缨 | 650 | 可口可乐 | 2 |
| 熏猪肉 | 46 | 红花油 | 0 | 土豆 | 3 | 绿茶 | 712 |
| 牛肝 | 92 | 绿豆 | 14 | 南瓜 | 2 | ||
| 猪肝 | 25 | 西红柿 | 5 | ||||
| 鸡肝 | 7 | 水田芥(watu cres) | 57 |
(2)需要量约为2μg·kg-1体重-1,大鼠为10μg·kg-1体重或0.1μg·g食物-1,无菌大鼠需要量为25μg·kg体重-1。
5.5.6 临十床十应用
除新生婴儿外,人类原发十性十VK缺乏较为罕见。新生儿在出生最初几日内无细菌,在胎儿期胎十盘不易运输脂类,凝血酶原常有低的现象,数周后方可上升至正常值,如果低至正常值的10%,新生儿将有出十血十性十疾病。水溶十性十及脂溶十性十的维生素K制剂,都能有效地恢复凝血酶原至正常水平,控制其出十血。有些老年人也有维生素K缺乏,出现凝血酶原时间长的现象。
预防血栓使用双羧香豆素过量时,凝血酶原也减少,可静脉注射药理剂量(以mg计的维生素K,使凝血酶原在数分钟内开始合成,24h达到正常水平。但水溶十性十维生素K3的衍生物转变为活化型维生素K的速度太慢,效果不好。在静脉营养中,输注射十液加入了抗生素,阻凝维生素K在肠道内合成,病人的需要维生素K的凝血因子在4周内降低至正常值的20%。在输注液中应加入维生素K0.03~1.5μg·kg体重-1。胆道阻塞时维生素K吸收减少,也可产生维生素K缺乏,口服或经消化道补给时,必须与胆盐同时供给,有些肝病,由于功能不全凝血因子合成减少,补给维生素K对凝血作用无效。
5.6 维生素B1
5.6.1 结构与十性十质
维生素B1又称硫胺素(Thiamine VB1),在室十温十下与中十性十亚硫酸钠溶液中分解嘧啶和噻唑两部分(图5-10)。它与焦磷酸生成硫胺素焦磷酸(Thiamine pyrophosphate,TPP),即羧化辅酶(cocarboxylase),这个反应需要ATP参加,结构式见图5-11。TPP参与糖代谢中α酮酸的氧化脱羧作用。
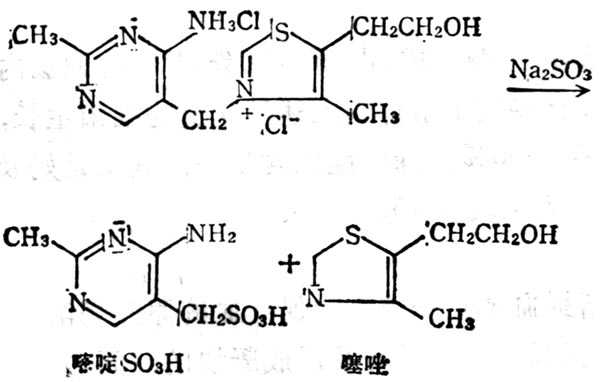
图5-10 维生素B1经Na2SO3分解为嘧啶和噻唑
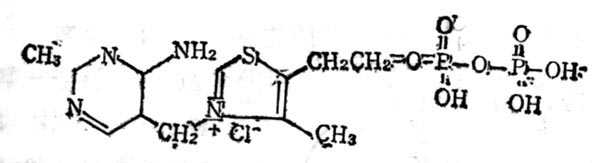
图5-11 羧化辅酶(TPP)的结构式
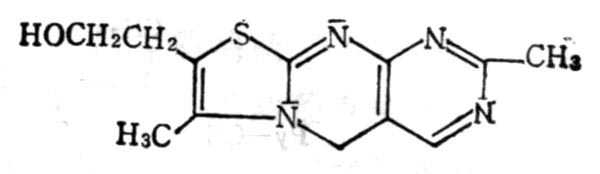
图5-12 硫色素分子式
维生素B1盐酸盐1g先溶于1ml水中,可在酒十精十中形成1%溶液,不溶于其他有机溶媒中。PH7时水溶液的紫外线吸收高十峰为235,267nm,相当于嘧啶及噻唑两部分。在PH1时,只有1个高十峰在247nm处,在260mn处有一个肩,也相当于这二个组成部分。在高十温十时,尤其在碱十性十溶液中,非常容易破坏,但在PH5以下易破坏。在碱十性十溶液中,在氧化剂(如高铁氰酸钾)可将维生素B1氧化为硫色素(Thiochrome),据此可用以测定VB1(图5-12)。
人工合成的VB1衍生物有丙基硫胺素二硫化物(Thiamin propyl disulfite,TPD)及4氢糖醛二硫硫胺素(thiamin tetrahydrofurfural disulfide TTFDD),不溶于水,被硫胺素酶破坏较少。口服后,血、组织及脑脊髓液中维生素B1的水平较服用维生素B1时要高甚至可高10倍。在消化道中也易吸收。因此这些衍生物常在临十床十上应用。有些衍生物如吡啶硫胺素(pyrithiamino)及氧代硫胺素有抗维生素B1作用,前者使大脑中维生素B1易于空竭,后者可导致除神经系统外其他系统的维生素B1缺乏症状。
5.6.2 代谢
维生素B1在小肠中吸收,浓度高时为扩散,低时为主动吸收,需要钠离子及ATP,缺乏钠离子及ATP酶可抑制其吸收。低水平时吸收约57.5%,高时约26.2%。维生素B1进入到小肠细胞磷酸化成酯,从小肠细胞出去,也需要正常浓度的钠离子及ATP酶。叶酸缺乏可影响维生素B1的吸收。
体内约有维生素B130mg,50%在肌肉中,骨骼、心、肝、肾及脑中较多,体内维生素B1的80%为TPP,10%为硫胺素三磷酸(TTP),还有一些硫胺素单磷酸及维生素B1。体内有三种酶参与形成上述的硫胺素磷酸化合物:硫胺素焦磷酸催化硫胺素与ATP作用形成TPP;TPP-ATP磷酸转移酶催化TPP+ATP→TPP;及硫胺素焦磷酸酶参与TPP→TMP的反应。
大鼠及人尿中有许多硫胺素代谢物,已知结构者仅6种,其中2-甲基4-氨基5嘧啶羧酸,4-甲基噻唑5-醋酸及硫胺素醋酸为最主要者。在大鼠中经酒十精十脱氢酶的作用,可以将硫胺素及噻唑氧化到相应的要酸。
5.6.3 生理功能
(1)硫胺素焦磷酸为羧化酶的辅酶,其作用机理如图5-13。
①在微生物中,丙酮酸脱羧变为乙醛而放出CO2。
②乙酰羧基酸的合成:乙酰羧基酸为合成支链氨基酸(缬氨酸,异亮氨酸等)的中间体。
③作为磷酸戊糖旁路中转酮酶的辅酶 糖的无氧酵解及有氧氧化是动物体内糖分解代谢的主要途径,但还有一部分经磷酸戊糖旁路代谢,在肝中他只占酵解及氧化途径的8%。其特点是通过脱氢与脱羧反应生成CO2及磷酸甘油醛及6-磷酸果糖,后二者仍进入酵解途径,其过程为葡萄糖磷酸化变为6-磷酸葡萄糖(G-6-P),在G-6-P脱氢酶的催化下,脱氢与水化合成6-磷酸葡糖酸,再经脱氢与脱羧等反应生成5-磷酸核酮酸,又转变为5-磷酸木酮糖及5-磷酸核糖,通过转酮糖酶(需要TPP,Mg2+)将酮糖上的二碳单位转移到另一个醛糖的1-C上,这个反应是可逆的,在这个循环上形成7C、6C、5C及4C磷酸单糖。
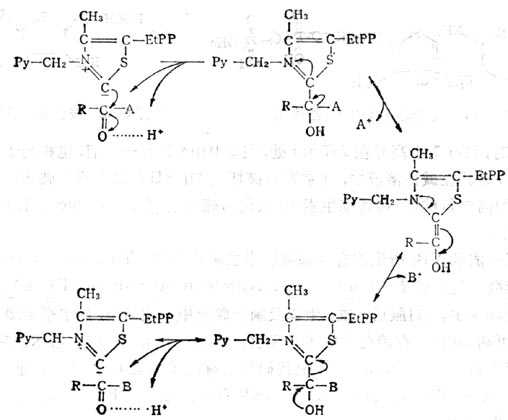
图5-13 维生素B1焦磷酸羧化酶的作用机制
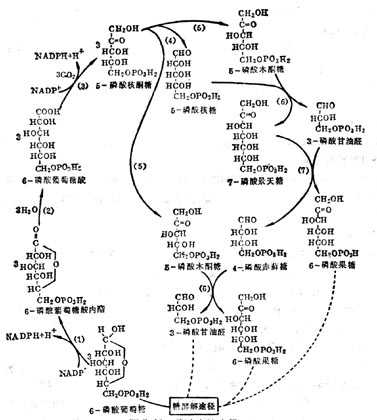
图5-14 磷酸戊糖途径
这个代谢的主要生理功能是产生核糖及NADPH。它是由葡萄糖产生5-磷酸核糖的唯一途径。在这个代谢中二脱氢酶(6-磷酸葡萄糖脱氢酶和6-磷酶葡糖酸脱氢酶)都是以NADP为辅酶,还原为NADPH。它为体内许多反应的供氢体,如脂肪酸、胆固醇、类固醇的合成都需要它,所以在上述反应比较旺盛的脂肪组织、哺十乳十期十乳十腺、肾十上十腺皮质、十睾十丸及肝脏等,这种代谢也比较旺盛。遗传十性十6-磷酸葡萄糖脱氢酶缺乏的病人,不能进行磷酸戊糖旁路循环,NADPH缺乏与GSH量低下,红细胞很易破坏而发生溶血十性十贫血。
④α酮脱氢酶(如丙酮酸、α-酮戊二酸)系统中的辅酶,这类酶系统分三步作用(图5-15)。
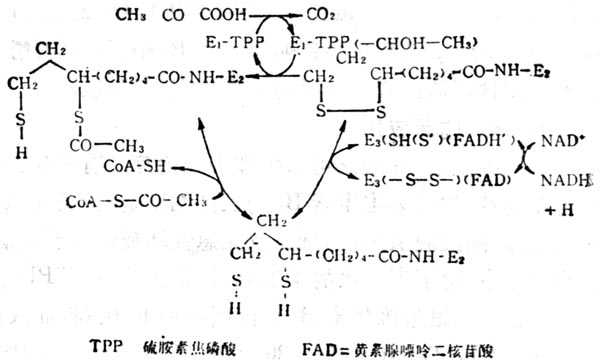
图5-15 -酮脱氢酶的作用
A 形成“活十性十醛”中间物,基质为α-酮酸与酶1(α-酮脱氢酶以硫胺素焦磷酸为辅酶)作用,脱羧后形成中间物。丙酶酸与酶作用的中间物为2-(羧乙基)硫胺素焦磷酸,α-酮戊二酸的中间物为2-(1,3羧基丙基)硫胺素焦磷酸。
B 将上述中间物转移至酶2的硫辛酸上。
C 将酰基转移至辅酶A上,而双氢硫辛酸被酶3脱氢形成硫辛酸。
(2)硫胺在神经生理上的作用 一个神经冲动可以使维生素B1磷酸化合物去磷酸,并使其在膜上十位移,Na+得以自十由通过膜,但有神经生理活十性十的维生素B1衍生物是焦磷酸衍生物还是三磷酸衍生物,现在尚不能肯定,对大脑功能作用,可能由于对5-羧色胺的纳入及磷脂合成有影响。
(3)硫胺素与心脏功能的关系 维生素B1缺乏引起心脏功能失调不是直接的作用,可能由于维生素B1缺乏使血流入到组织之量增多,使心脏输出增加负担过重,或由于维生素B1缺乏,心肌能量代谢不全。
5.6.4 猪牛肉、肝、肾等,全麦、糙米、新鲜蔬菜,豆类等富含维生素B1但是食物中有些因子可使维生素B1构造改变,活力减低。这种抗维生素B1的因子分二种:一种易被热破坏,如硫胺素酶Ⅰ及Ⅱ,前者在淡水鱼及贝类内脏内,催化硫胺素的分解。后者存于某些生物中,催化维生素B1的分解,对热稳定的抗维生素B1因子存在于植物中,它可能与3,4双羧基肉桂酸和单宁酸有关。低维生素B1摄取量的人群,如果多吃些抗B1因子,可导致维生素B1缺乏。
谷类在除去麸皮与糖的过程中,维生素B1损失很多,国外对十精十加工后的面粉都强化维生素与矿物质使其量相当于粗制品,这点应引起我国食品工业部门及消费者的注意,烹调加碱可使维生素B1损失。
5.6.5 需要量
评定维生素B1营养状况的指标一般以尿中排十出量为准,可以用每克肌酐排十出的维生素B1表示之。红细胞的转酮酶以维生素B1为辅酶,也用以测定人十体的维生素B1营养状态。
成十人维生素B1需要量为1.26~1.47mg·1000Kj-1,在这种摄取量的情况下,每日尿排十出量为40~90ug,若摄取量增加到2.1mg·1000Kj-1,每日尿排十出量为100ug或以上。若摄取量减低到0.84 mg·1000Kj-1,尿排十出量为5~25ug。脚气病患者可低至0~15ug或以上。我国及美国提出供应量为2.1mg·1000Kj-1。老人利用硫胺素的效率较低,所以为4.2 mg·1000Kj-1。男十性十成十人每日1.2~1.5mg,女1.0~1.1mg,孕妇与十乳十母将其供应量增加0.3mg,儿童供应量0~6个月0.3mg,6个月~1周岁0.5mg,1~3周岁0.7mg,4~6岁0.9mg,7~10岁1.2mg,男11~14岁1.4mg,女11~14岁1.2mg。饮酒过量者维生素B1需要量增加,动物试验说明维生素B1缺乏者,酒十精十自十由饮用量增加,长期饮酒者可以导致不十良饮食十习十惯或者干扰肠对维生素B1的吸收。
5.6.6 临十床十应用
单纯维生素B1缺乏可用生理剂量治疗。有些先天十性十代谢上需要维生素B1的疾病需要用十药理剂量,如需要维生素B1的巨红细胞贫血,十乳十酸尿(肝中丙酮酸脱羧酶活力低),支链酮酸尿(支链酮酸脱氢酶活力低)及亚急十性十坏死十性十脑脊髓病)(神经系统中缺乏TTP)。在这些病的治疗中,用不溶于水的维生素B1衍生物(如TPD,TTFD)比用维生素B1的效果要好。
静脉注射过量维生素B1可因呼吸中枢压抑而致死,其致死量每公斤体重:小鼠125mg,大鼠250mg,兔子300mg,狗350mg。静脉、皮下及口服致死量这比例为1:6:40。猴子注射每公斤体重600mg时,可产生中毒现象。人口服大剂量维生素B1,未发生过中 毒十症象。皮下、肌肉、脊椎、静脉内每日注射正常量的1~200倍时,亦未发生中毒现象。但有些人接受大剂量后,发生过敏十性十休克。
5.7 维生素B2
5.7.1 结构及十性十质
维生素B2又名核黄素(Riboflavin,VB2),它是核醇与7,8-二甲基异略嗪的缩合物(图5-1`6);为黄褐色针状结晶,溶解度较小,在27.5℃时溶解度为12mg%。核黄素5-磷酸较易溶解,二者在碱十性十溶十性十液及光照下均易分解,其荧光由于三位亚氨基。光分解侧链可得光色素、光黄素及甲酰甲基黄素。在消化道内,肠内微生物也可将其分解为甲酰甲基黄素等(图5-170。
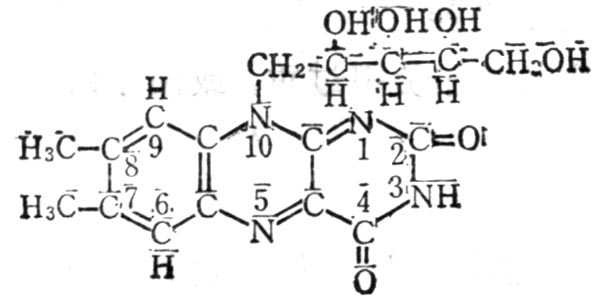
图5-16 维生素B2结构式
植物能合成核黄素,动物一般不能合成,必须由食物供给,但在哺十乳十动物肠道中的微生物可以合成并为动物吸收,但其量甚微,不能满足需要。
核黄素的辅酶有二种形式;即黄素单核苷酸(FMN)和黄素腺嘌呤二核苷酸(FAD)(图 5-18)。
5.7.2 代谢
核黄素或其辅酶在食物中与蛋白质结合形成复合物——黄素蛋白,从十乳十、蛋中得来后,经消化道内蛋白酶、焦磷酸酶水解为核黄素。有些黄素蛋白释放出8α-氨基酸(半胱氨酸或组氨酸)核黄素可以吸收,但无生物效用。
人在小肠近端吸收核黄素。正常人吸收迅速,吸收量与剂量成比例,直到摄取量为25mg时都很稳定。核黄素与其他食品一起摄入,增加其吸收。肠胃道功能紊乱及胆管阻塞都可导致吸收不十良。维生素B2在大肠内也可吸收、吸收的机理因剂量大小而异,低剂量时为主动吸收,需要Na+。在剂量为0.2ugmol时,有最大的吸收率,大剂量时为扩散吸收。
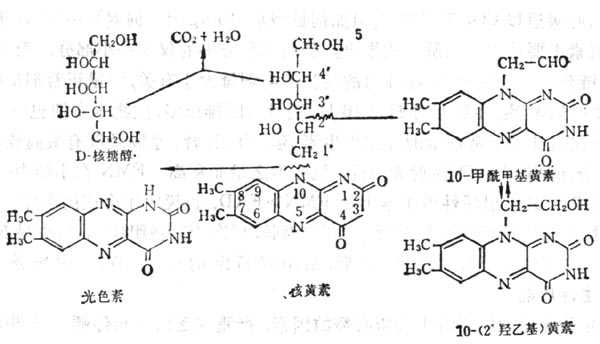
图5-17 核黄素5-磷酸的分解产物
维生素B2都是以辅酶形式存在于血、组织及体十液中,从血流到组织(如肝)细胞中,游离式的核黄素,才能透过细胞膜到细胞内。核黄素类似物如半十乳十糖黄素及核黄黄素,可能阻止维生B2在黄素激酶(Flavokinase)作用下,转变为FMN。这种激酶存于许多细胞浆内,但在肝及小肠内的活力特别高。黄素激酶作用时需要ATP及二价十陽十离子,它也作于维生素B2的类似物,氨基酸的衍生物为干扰剂。维生素B2除掉侧链后生成物,如光黄素都是干扰剂。
FAD是由FMN通过FAD合成酶作用形成的。此酶广泛存在于组织的胞浆内,也需要ATP二价十陽十离子,FMN及其类似物都可作为底物、异核黄素干扰其活力,对FMN及FAD有拮抗作用。维生素B2缺乏及甲状腺过多时,FAD合成酶活力增加。
水解FMN及FAD的酶广泛存在各组织中。FMN磷酶在碱十性十或酸十性十中都能作用,在肝中酸十性十磷酸对FMN的作用较强,在维生素B2缺乏时,并不影响FMN磷酸酶的活力。FAD焦磷酸酶也能促使FAD水解。它在肝病病人的血清中升高。
维生素B2经肾小球滤过,可在肾小管中再吸收。在血清维生素B2浓度低时,尿排十出量较少,为一常数。但血清维生素B2达到1μg·ml-1时,排十出增多。维生素B2摄取量愈小,体内储存百分率愈大。给予大鼠55μg14C-一维生素B2,10%的14C从尿中排十出,3%在大便中排十出,1%从呼吸道以CO2形式排十出。但如剂量增加(15μg·ml-1饲料),10%14C从便中排十出。所以核黄素主要从尿中以游离式排十出。肠道细菌分解的仅为一小部分,而且环状部比较稳定,仅侧链分解。维生素B2在体内的转换率与剂量大小有关,大鼠正常剂量时,每日排十出15~20μg维生素B2,生物半寿期为16日,剂量大时排十出多,生物半寿期也短。
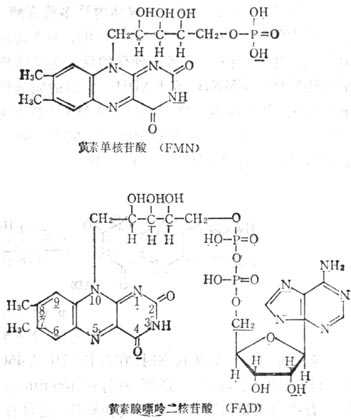
图5-18 核黄素嘌呤二核苷酸(FAD)
5.7.3 生理功能
维生素B2是维持动物正常生长所必需的因素,严重缺乏时生长停顿。有些局部损害,如在口角处因维生素B2的缺乏而发生糜烂。在怀孕时,如维生素B2缺乏,可致畸胎,但在人类尚未发生这种情况。动物试验证明有些白内障与维生素B2缺乏有关,可用FAD预防。
维生素B2主要功能是构成体内许多黄素酶中的辅酶(FMN,FAD)。这些酶为电子传递系统中的氧化酶及脱氢酶(图5-19),前者将还原型的辅酶与分子氧直接起作用,生成过氧化氢,作用较快。后者所催化的反应是从底物上将一双氢原子直接递给FMN或FAD,形成还原型的FMNH2或FADH2,它们的脱氢仍需呼吸链上的其他因素,不能直接被分子氧所氧化,作用缓慢。在缓慢。在呼吸链上FMNH或FADH氧化能力比NADPH要强一引起,它可以直接与氧作用,而NAPH只能间接与氧作用。FMN或FAD常常是接受NADPH递给的氢使其变成FMNH或FADH。
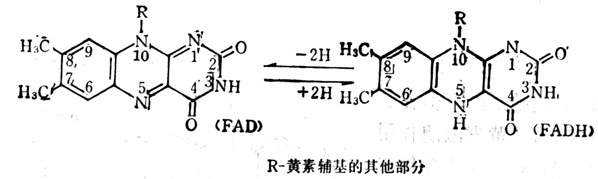
图5-19 黄素酶的作用
黄素蛋白处于氧化状态时,在波长370及450nm处,有较宽的吸收峰;处于还原态时,在450nm的峰消失。有些黄素蛋白除含黄核苷酸外,还含有金属离子(如铁、钼、锌),也是这些酶所需要的。
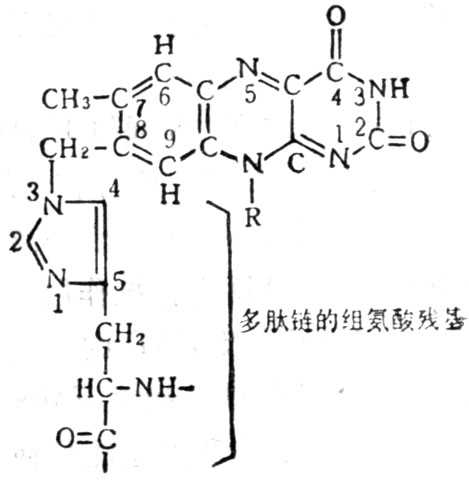
图5-20 琥珀酸脱氢酶中的组氨酸
FMN或FAD与酶蛋白结合,一般是通过 8位上的亚甲基与酶蛋白上的半胱酸、组氧酸或氨酸相联结。(图5-20)。维生素B2辅酶有三种功能形式图5-21。
(1)以维生素B2为辅酶的氧化酶可分为下列类型:
① 黄素接受电子后又被氧化形成H2O2如葡萄糖氧化酶。
图5-21 维生素B2辅酶三种功能形式
D-葡萄糖+O2→D-葡萄糖内酯+H2O2
② 形成底物-酶复合十体并继续继续形成中间体,直到与O2作用后,此底物脱氢与复合十体分开,如d,1-氨基酸氧化酶。中间体可能为辅酶与底物相偶联,与O2作用后,亚氨基酸水解为α-酮酸及氨,并生成氧化型的酶及H202。
③黄嘌呤氧化酶更为复杂,有二个活动点,一个活动点有1个Mo原子与二个Fe-S中心,Fe-S中心为了维持Mo在氧化状态,另一活动点为FAD分子。底物首先与氧化Mo(6价)作用,再与FAD作用形成FADH2形成FADH2,最后与氧化作用形成H2O2。
黄嘌呤+H2O2+O2→尿酸+H2O2
④混合功能氧化酶(黄素单氧化酶),如此类酶催化氧分子中的一个氧原子到底物中去另一个原子形成水。如底物本身供给电子以水者叫做内部黄素氧化酶,其反应式如下:其中-XH可为-OH或-NH2。
如果由NADPH(或NADH)作为还原剂以形成水者,叫做外部黄素氧化酶,一些芳十香族化合物的羧基化(如肝犬尿氨酸羧化酶)需要此酶,反应式如下:
AH+NAD(P)H+H++O2→A-OH+H2O+NAD(P)+(AH为底物)
实际上这些羧基化酶的辅酶(核黄素部分)先氧化为氧化型者,则与NAD(P)H作用又还原为还原型者。
⑤微粒体混合功能氨氧化酶,此酶在肝微粒体中,其底物为半胱胺,氧化为胱胺,除黄素蛋白外,还需要NADPH及氧的参加,此反应产生-S-S-以合成蛋白的双硫键。
(2)维生素B2脱氢酶。无金属黄素蛋白的脱氢酶,包括有二氢硫辛酰胺脱氢酶(dihydro lipoamide dehydrogenase)、麦胱甘肽还原酶(glutathione reduetase)、硫氧还蛋白还原酶(thioredoxin reductase)、NADH-细胞色素b3还原酶(NADH-cyutochrome b2reductase)及NAD(P)H-细胞色素P450还原酶(NAD(P)H-cytoehrome P-450reductase)前三者为NAD(P)双硫氧化原酶系统(图5-22)。
NADH-细胞色b3还原酶催化NADH的H转移至FAD而形成FADH2再将电子转移到氧化型细胞色素b3上将其还原,NADPH-细胞色素P450还原酶电子供体为NADPH,但还有一分子FAD及一个分子FMN,微粒体中NADPH-细胞色素C还原酶包括2个分子FAD。
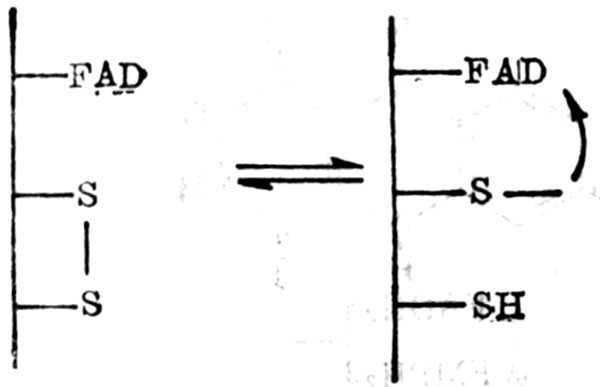
图5-22 FAD-双硫氧化还原酶系统
含金属的黄素蛋白脱氢酶数量很多,包括呼吸链中含有NAD(P)H的脱氢酶,其中研究较多者为NADH脱氢酶及琥珀酸脱氢酶,因其与氧化磷酸化有联系。琥珀酸脱氢酶与FAD及2个Fe-S中心偶联,再与辅酶Q相联。NADH-辅酶Q脱氢酶每个FMN有4个Fe-S中心,每个中心有2~4个铁原子,NADH还原黄素蛋白,然后将电子传递到离NAD相近Fe-S中心,再传递到与辅酶Q相近的Fe-S中心,最后传递到辅酶Q上。
另外在线粒体中有溶解的FAD蛋白,它把酰基CoA脱氢酶的氧化作用与辅酶Q的还原联系起来。这种FAD蛋白叫做电子传递蛋白(electron-transferring flavoprotein,ETF)。
5.7.4 来源
肠中细菌可以合成维生素B2,但为量不多,主要尚须依赖食物中供给。牛十奶十、鸡蛋含维生素B2比较丰富,绿色蔬菜中也有,但植物十性十食品的维生素B2含量不高。我国以植物十性十食品为主,维生素B2摄取量偏低。维生素B2热较稳定,但在光的影响下,易于破坏。牛十奶十中的维生素B2暴露在光中,在不正常味道发生前,光分解就已发生。放置在光中4h,维生素B2损失约71%,烹调损失较小,但如将烹调水废弃,溶于水的维生素B2遭到损失。将维生素B2混入食物中,在储藏过程也比较稳定。在室十温十中,充氨密封条件下,储存1~2年,还能保存50%以上。
5.7.5 需要量
(1)营养评价指标 一般仍以尿中维生素B2排十出量、红细胞维生素B2含量及红细胞麦胱甘胱还原酶活力等为维生素B2的营养指标,其中较为灵敏者为红细胞麦胱甘肽还原酶。大鼠肝及器官中都有磷吡哆胺氧化酶(pyridoxamine 5'-phosphate oxidase),如大鼠缺乏维生素B2,此酶活力有改变,缺乏4周时达到严重缺乏程度,此酶活力也降至最低值,这个指标仍在动物试验阶段。
(2)需要量 从我国维生素B2需要量的试验结果来看,每日摄取量0.70~1.16mg者,试验期共计10周,舌面十乳十头渐趋扁平、光滑甚或萎十缩,但无其他缺乏症象。摄取量12.53mg组,尿排十出量上升,根据其转折点计算相当1.2mg摄取量,所以以此为最低需要量,1.5mg为适宜要量。这与Horwitt综合其他作者之结果是一致的。他认为每日摄取量的0.8~0.9mg2年之久,并无缺乏症象的出现,从尿排十出量来看,摄取量1.2mg,维生素B2在组织中可能有少量储存。摄取量0.55~1.10mg·d-1尿中维生素B2排十出量为摄取量的10%,每日摄取量1.3mg或更高时,排十出量大于20%。
维生素B2的需要量与热量及劳动强度没有关系,但与蛋白质需要量有关系,生长迅速,创伤恢复,怀孕与哺十乳十期蛋白质需要增加,维生素B2需要量也增加。供应量婴儿每日0.4~0.6mg,儿童0.6~1.2mg,成十人1.3~1.7mg,孕妇及十乳十母1.8~2.0mg。治疗剂量为一次6mg或一次2mg·d-1,每日3次,由于维生素B2不易溶解,如期望治疗效果快一些,可用肌肉注射25mg维生素B2。为了预防我国维生素B2缺乏,以维生素B2月桂酸酯150mg(相当于75mg维生素B2)油针剂肌肉注射,由于释放缓慢,注射一次可维持成十人维生素B2正常达2~3月之久。
5.8 尼克酸
5.8.1 结构与十性十质
尼克酸亦名烟酸,具有生理活十性十的衍生物为尼克酰胺,亦名烟酰胺(nicotinamide),结构式如图5-23。尼克酸为不吸水的较稳定的白色结晶,在230℃升华,能溶于水及溶于水及酒十精十中,25℃时,1g能溶于60ml水或80ml酒十精十中,不溶于乙醚中。尼克酸很容易变成尼克酰胺,它比尼克酸更易溶解,1g可溶于1ml水或1.5ml酒十精十中,在乙醚中也能溶解。
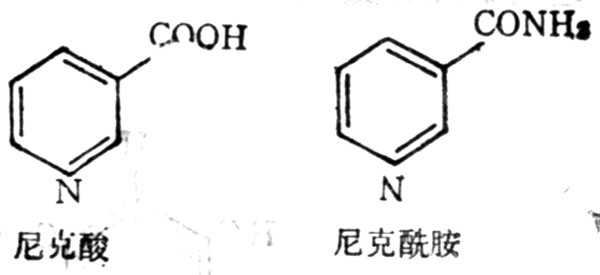
图5-23 尼克酸尼克酰胺结构式
5.8.2 代谢
尼克酰胺通过ATP作用形成NAD或NADP。在尿中排十出的尼克酰胺甚少,主要排十出其代谢产物N‘-甲尼克酰胺及N’甲-2吡酮-5-甲酰胺。前者约占正常人的排十出量的20~30%,后者为40~60%。血清中尼克酰胺含量甚微,仅为0.5μg·ml-1,红、白细胞中含量较多,全血为30μg·ml-1,红细胞为90μg·ml-1,白细胞为70μg·ml-1。
5.8.3 生理功能
尼克酰胺为辅酰Ⅰ及辅酶Ⅱ的组成成分。辅酶Ⅰ为尼克酰胺腺嘌呤二核苷酸(NAD+或DPN+),辅酶Ⅱ为尼克酰胺腺嘌呤二核苷酸磷酸(NADP+或TPN+)(图5-24)。它们都是脱氢酶的辅酶,氢的传递通过在尼克酰胺4位上增加一个氢原子。在立体上又分为A、B二个部位,某些尼克酰胺脱氢酶具有立体专一十性十(图5-25)。其立体专一十性十表现为两个方面:一方面只对一种立体异构体的底物有催化作用,如十乳十酸脱氢酶脱氢酶只作用于十乳十酸。另一方NAD+或NAP+被酶还原时,氢原子只在一个特定的方向加到吡啶环的第四位碳原子上,有的加到A侧,有的加到B侧。
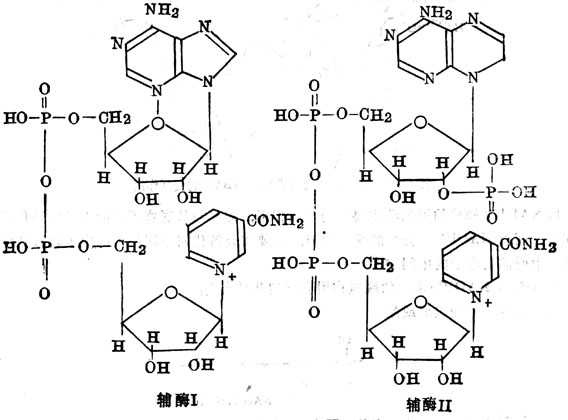
图5-24 辅酶Ⅰ及Ⅱ的结构
需要辅酶Ⅰ、Ⅱ的脱氢酶有数百种,这些脱氢酶从底物中提取一个氢,二个电子,其结构通过X光衍射图看出脱氢酶与NAD+及底物的结构。图5-26表明十乳十酸脱氢酶与NAD+及底物的关系。底物十乳十酸给NAD+一个H,底物的羟基与酶的十精十氨酸(171)的胍基相连,而在组氨酸(195)中OH基中提取一个质子。其他脱氢酶的构象与之相同。

图5-25 尼克酰胺4位C上联结H的主体构造:A,B二个位置
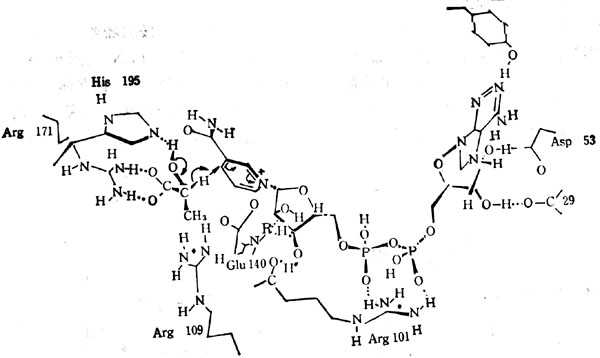
图5-26 十乳十酸脱氢酶十乳十酸及NAD+的十十交十十互作用
以NAD+为辅酶的脱氢酶主要参与呼吸作用,即参与从底物到氧的电子传递作用的中间环节。而以NADP+为辅酶脱氢酶类,主要将分解代谢中间物上的电子转移到生物合成反应中所需要电子的中间物上。
NAD+(或NADP+)参与的脱氢作用下列几种类型:
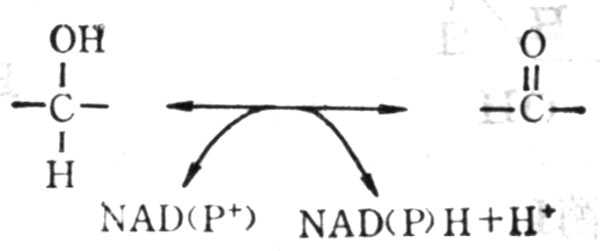
(1) 底物由醇变成醛或酮
(2) 加十陰十离子A-到醛而脱氢
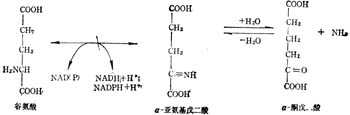
谷氨酸脱酶是谷氨酸脱氨的第一步,形成α-亚氨基戊二酸。
谷氨酸 α-亚氨基戊二酸α-酮戊酸

(4)由不饱和合键(——C——C——)到饱和键。由7-脱氢胆固醇转变为胆固醇,7α-H+从NADPH而来,而8β氢从介质而来。在胆固醇合成中,固醇载体蛋白将在胞液中形成的鲨烯转运至微粒体环化成羊十毛十脂固醇,再转变为链固醇。链固醇转变为胆固醇需要由NADPH供给25位氢,从介质中供给24位H+。
链固醇(又名24-脱氢胆固醇 胆固醇
(5)二硫键转为二硫醇键;许多酶催化这个反应,辅酶Ⅰ、Ⅱ为H+的供体或受体。如胱氨酸还原酶的作用为NADH2+1-胱氨酸→NAD+C+2-半胱酸。麦胱甘肽还原酶的作用为NAD(P)——H2氧化麦胱甘肽→NAD(P)+2G还原型麦胱甘肽。
在α-酮酸脱氢酶系统中,硫辛酸脱氢酶通过NADPH+与黄素蛋白作用,将H转移。
(6)苯丙氨酸通过苯氨酸4-单加氧酶(即苯氨酸羧化酶)的作用,变成酪氨酸。这个酶可作为单加氧酶可作为单加氧酶或混合功能加氧酶的代表,它的作用是将氧分子中的一个氧原子加到苯丙氨酸上形成对羧基,另一个氧原子还原成水。还原剂是NADPH,反应分两步进行:
NADPH+H++二氢生物蝶呤→NADPH++四氢生物蝶呤。
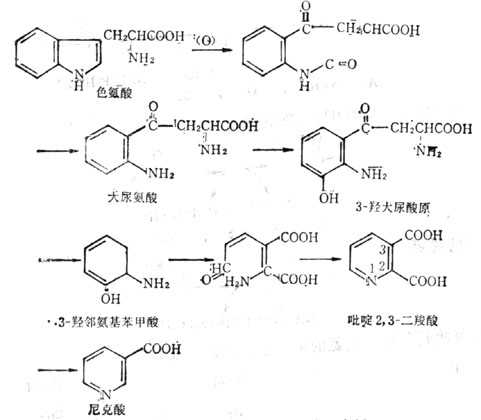
图5-27 色氨酸转变为尼克酸的途径
1-苯丙氨酸+四氢生物蝶呤+O2→1-酪氨酸+二氢生物蝶呤+H2O。
5.8.4 来源
尼克酸或尼克酰胺的来源除食物含有者外,尚可由色氨酸在体内转变为酰犬尿氨酸到犬尿氨酸,再由1-犬尿酸水解酶分解犬尿酸或黄尿酸为3-羧氨基苯四酸,然后在5磷酸核糖焦磷酸存在下,由哺十乳十类肝的酶系统变成尼克酸。一般说来,60mg色氨酸相当于1mg尼克酸。食物中尼克酸的当量为尼克酸及色氨酸转换为尼克酸之和(表5-16)。但转换能力因人而异,晚期孕妇转换能力3倍于正常妇女。雌十激十素可刺激色氨酸氧化酶,它是色氨酸转为尼克酸过程中的速率限制酶,因此孕妇及口服药者转换能力较强。
表5-16食物中尼克酸当理(mg·1000Kj-1)
| 尼克酸 | 色氨酸 | 尼克酸当量 | |
| 牛十奶十 | 5.08 | 283 | |
| 人十乳十 | 10.3 | 1681 | 32.1 |
| 牛肉 | 103.7 | 5376 | 193 |
| 全蛋 | 2.5 | 4830 | 45.4 |
| 腌猪肉 | 4.8 | 256 | 11 |
| 面粉 | 10.4 | 1247 | 32 |
| 玉米渣 | 7.7 | 294 | 13 |
| 玉米 | 21 | 445 | 28 |
谷类中有结合型的尼克酸,不能利用。可分为二种结合物:①与肽链(分子量12,000~13,000)结合;②与碳水化物结合成复合十体(分子量为370)。麸皮中有这种结合型的尼克酸(niacytin),用碱提取(或碱水解)和谷物,其尼克酸测定值较酸十性十或中十性十提取液的高20%,谷类通过培育新品种可使色氨酸增加,也可使其成为尼克酸来源。我国已培育出高色氨酸品种的玉米可治疗尼克酸缺乏引起的瘌皮病。
大剂量的亮氨酸可使癞皮病发生。Jowar(一种食物)尼克酸及色氨酸量不少,但因亮氨酸量大,也可使癞皮病发生。在大鼠的酪蛋白饲料中,若增加亮氨酸,尿中吡啶-2-3-二羧酸增加,可能影响色氨酸向尼克酸的转变。正常人的正常膳食中增加亮氨酸可以增加尿中吡啶二羧酸,而四基尼克酸胺及-6吡啶酮的排十出量减少。
5.8.5 需要量及临十床十应用
尼克酸供应量为27.7mg·100K十J-1。婴儿0~6个月为33.6 mg·100K十J-1,2/3来源于色氨酸,一般75g蛋白有尼克酸当量NE15mg,6个月~青年时期为27.7mg·100K十J-1,孕妇增加2mg,十乳十母增加4mg。
尼可酸缺乏症可用生理剂量治疗。尼克酸及尼克酸胺对治疗及预防癞皮病有相同效果,但在药理上及毒十性十上二者不完全相同。尼克酸3g以上有药理作用,可使血中胆固醇、β-脂蛋白及甘油三酯量减低。可能由于减少从脂肪组织中动员出来脂肪酸,而增加肌肉或心肌的肝糖原的利用。因此长期使用易有糖尿病,对肝不利。它能导致组胺的释放,可使血管扩张,脸红为主要的副作用。如果在给药前15min给以抗组胺药,可以抑制脸红。尼克酸可以增加血清尿酸水平,每日3g剂量长达5年,可以使血清尿酸超过8mg%。在大剂量时,尼克酸与尿酸竟争排十出,由于血清尿酸增加,所以大剂量尼克酸摄取者易患急十性十痛风症。
5.9 维生素B6
5.9.1 结构与十性十质
维生素B6(VB6)有三种形式:吡哆醇(Pyridoxine,PN),吡哆醛(Pyridoxal,PA或PL)和吡哆胺(Pyridoxamine,PM)。这三种形式通过酶可互相转换。PL及PM磷酸化后变化辅酶,磷酸吡哆醛(PLP)及磷酸吡哆胺(PMP),其结构式如图5-28)。
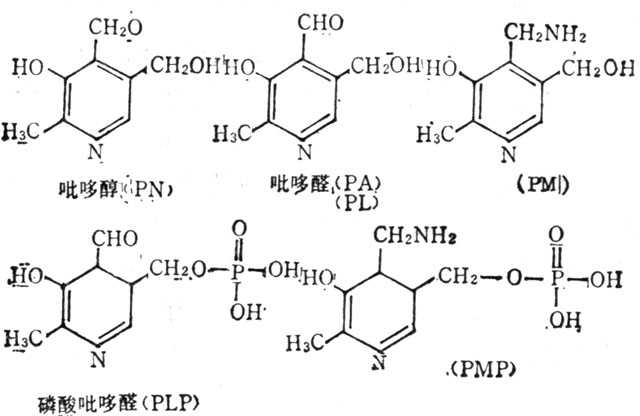
图5-28 维生素B6及其辅酶的结构式
人、大鼠、小鼠、鸡、狗、火鸡等甚至有些微生物都需要维生素B6,牛马等由于肠道中能合成,不需要外界供给。吡哆醇为人工合成的产品,在植物中也有,分子量为205.6,系白色板状结晶,溶于水,在酸十性十溶液中稳定,在碱十性十溶液中易被光所破坏。在动物体内,多以辅酶PLP及PMP的形式存在。有些类似物,如4-脱氧吡哆醇则有抗维生素B6的作用。
5.9.2 代谢
维生素B6的各形式在体内的变化如下:
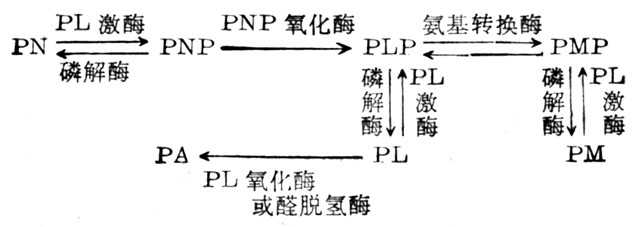
PN、PL、PM的磷酸体均由PL激酶(ATP:Pyridoxal-5'-phosphotranferase,PL Kinase)所催化,但其在各组织中如肝、脑及红细胞中最适PH金属离子需要量及分子量均不一样。PNP(PMP)氧化酶(Pyridoxic Acid,PA)为代谢最终产物,由尿中排十出,在肝中PL由醛氧化酶催化形成,在其他组织中由需要NAD的醛脱氨酶催化而形成。
(1)消化与吸收 食物中维生素B6为PLP、PMP、PN在小肠腔十内必须由非特异十性十磷解酶(nospecific phosphohYdrolase)分解PLP、PMP为PL,PM。吸收形式为PL、PM及PN。在人十体观察中,给予饥饿的人以PN、PL、PM,在给予PN后0.5~3h达到高十峰,剂量小(0.5~4mg)时,血浆维生素B6水平在3~5h后又恢复到近似饥饿时水平。服用PL后血浆维生素B6水平及尿中PA升高较快,但PM吸收代谢都较PN,PL要慢一些。而摄入PLP剂量大(如10mg)时,血浆维生素B6及PLP在24h内继续上升,维持在高水平上。
(2)运输与代谢 PN运输至小肠粘十膜并到血流中,也可在肠粘十膜中合成PNP,约为剂量30.6%,血流中PN可扩散到肌肉中,然后磷酸化约占剂量的10.4%~15.7%。在人十体给以PN后,血浆PL可以增加12倍,血浆中PLP虽占血浆中维生素B6的60%,但与蛋白相结合,不易为其他细胞所利用。血浆中PL与白蛋白结合不牢固,为运输的形式,能被组织摄取与清除,并氧化为PA。PN及PL通过扩散进入到红细胞中,并为激酶磷酸化。人的红细胞可将PNP氧化PLP,其他动物如大鼠无此功能。PN在超过红细胞PL激酶饱合浓度时,可在3~5min进入到红细胞中,细胞内的浓度与培养基浓度一致。PL在浓度超过红细胞磷酸激酶的浓度时,进入红细胞的量增加,使其浓度比培养基中要高这是由于PL与血红蛋白α-链中末端缬氨酸相结合,所以PL在红细胞中积累,它在红细胞中的浓度可为血浆中之4~5倍。红细胞中的PL可能也是一种运输方式。
肝也是维生素B6代谢活跃的组织。PN为肝细胞纳入后,相继为PL激酶及PNP氧化酶作用而生成PLP,然后再经磷解作用而转变为PL,进入循环系统中,运至有磷酸激酶的组织形成PLP。
在脑切片及分离脉络丛中,没有PN,均是磷酸化合物、脉络丛为运输PN从血到脑脊液的场所。在维生素B6缺乏的动物(大鼠)PL激酶有所下降,饲料5周的大鼠肝中,PL肝激酶下降50%而脑中仅下降14%。这也说明维生素B6对神经系统的重要十性十。
(3)储存 维生素B6在血流中可扩散到肌肉中而磷酸化,若PN剂量增加,肌肉中PN占剂量的百分数增加,而PNP的百分数减少。在肌肉中未发现PNP氧化到PLP。在大鼠60%维生素B6在肌肉中,其中75~95%与糖原磷酸化酶(Glycogenphosphorylase)相联系。此酶占肌肉可溶十性十蛋白之5%,可能为维生素B6的储存场所。通过肌肉蛋白的转换,将维生素B6分解出来以满足最低需要量。
(4)排十出 维生素B6的主要代谢产物PA,可代表维生素B6摄取入量的20~40%,尿中PA只可为摄入量的指标。而不能代表体内的储存。尿中除PA外,尚有小量的PN、PL等。给以生理剂量时,在3h内大部分以PA排十出。PN在肾小管中积累,当PN浓度较大时,可由肾排十出。因此PN剂量10mg时,尿中PA占剂量的百分数减低,但PN的排十出增多。PL不易被肾排除,也不易被肾纳入,纳入后以磷酸化形式积累。但人口服大剂量(100mg)PL、PM、PN后,在36h内大部分原物从尿中排十出。
5.9.3 生理功用
含有维生素B6的辅酶主要与代谢有关,现已知有60多种酶需要维生素B6。将其主要功用分述如下。
(1)氨基转换作用 转氨酶主要为谷草转氨酶与谷丙转氨酶。转氨酶中都有PLP为辅酶。
转氨酶在动物心、禽、肾、十睾十丸及肝中含量都很高,大多数转氨酶需要α-酮戊二酸作为氨基的受体。因此,不同转氨酶对相偶联的两个底物之一,即α-酮戊二酸或谷氨酸是有特异十性十的,而对另一个底物(即被脱氨的氨基酸)无严格的特异十性十。某种酶对某些氨基酸有较大的催化作用,但对其他氨基酸也有一定作用。酶的命名就是根据具有最大被催化能力的氨基酸而定的。例如,在动物组织中占优势的转氨酶是门冬氨酸转氨酶,除以门冬氨酸的作为酸为供体,α-酮戊二酸为受体。转氨酶反应都是逆的。在生物体内,转氨作用紧接进行氨基酸的氧化分解,可促氨基酸转氨作用向一个方向进行。
(2)脱羧基作用 氨基酸脱酸形成伯胺,脱酸酶的专一十性十很高,一种氨基酸脱羧酶只对一种1-氨基酸起作用。氨基酸脱酶中,除组氨酸脱酶不需要辅酶外,各种脱酸羧酶都以PLP为辅酶。这些脱羧作用对于哺十乳十类的组织很重要。有引起神经递质的形成有赖于他的作用。如芳十香族1-氨基酸脱羧酶参与酪、组、多巴,色氨酸的脱羧,形成相应的胺,如酪胺、组胺、多巴胺、5-羧色胺。半胱亚磺酸脱羧变成牛磺酸。谷氨酸在中枢神经系统脱羧形成γ-氨基丁酸。
色氨酸的代谢途径有二:一是在转氨酶的影响下分别变成犬尿酸和黄尿酸,二是在犬尿酸还原酶作用下,变成邻氨苯甲酸及3-羧邻氨苯甲酸与丙氨酸,再变成尼克酸。在代谢途径中有种B族维生素参与反应,与维生素B6有关者数处(图5-29)。但当维生素B6缺乏时,对各种反应影响程度不同,但对尼克酸不易生成的反应较大,对黄尿酸生成影响较少。所以B6缺乏时,尼克酸不易生成,尿中黄尿酸排十出增多。
(3)侧链分解作用 含羟基的苏氨酸或丝氨酸可分解为甘氨酸及乙醛或甲醛,催化此反应的酶为丝氨酸转羧甲基酶,该酶能够催化丝氨酸或苏氨酸两种氨基酸发生生醇醛分裂反应。该酶辅酶PLP。
5.9.4 来源
维生素B6可在肠中由细菌合成,但不能满足需要。他在食物中分布较广,肉、谷类、硬果、水果和蔬菜中都有。植物中以PN为主,动物体中PLP与PMP。肉为维生素B6较丰富的来源,十乳十中B6的含量反映母体维生素B6的营养水平,母亲每日摄取量2.5mg时,可使十乳十中维生素B6的量为0.2mg。在全麦中维生素B6,85%的含量在研磨粉加工中损失,若将维生素B6强化到白面包中,其生物效用要比全麦粉中者高一些,因全麦粉中者从大便排十出较多。膨化谷物中维生素B6生物效用较低,烹调过程中也有损失,在热血加工及储存过程中,他的生物效用减低,可能只有40~50%的生物活十性十。这是由于在这些过程中PLP与酶蛋白的赖氨酸所形成的希夫碱被还原而形成ξ-吡哆酰赖氨酸(ξ-pyridoxyllysine),使其生物效用减低。一些常见食品中维生素B6含量列于麦5-17中。
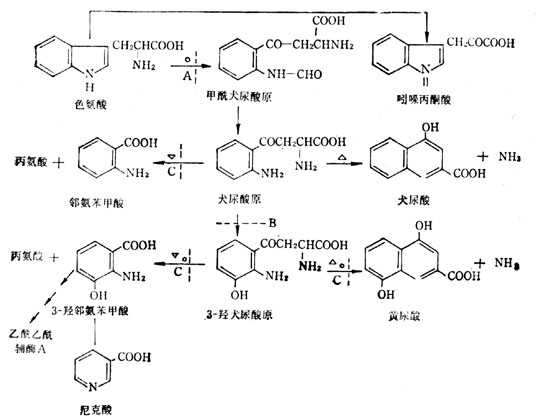
图5-29 色氨酸的分解代谢
5.9.5 需要量
(1)缺乏症象 维生素B6为氨基酸、糖及脂类代谢上的辅酶,促进合成一些神经递质如儿茶酚胺、5-羧色胺。大鼠维生素B6缺乏可以导致生长不十良、肌肉萎十缩、脂肪肝、惊厥、贫血、生十殖系统功能破坏、水肿及肾十上十腺增大。也影响维生素B6的孕妇,影响子代脑细胞的发展。
婴儿给以维生素B6缺乏膳数月后,生长停止,尿中无PA,PN也很低,。有惊厥贫血现象,色氨酸转变为尼克酸能力丧失。给以维生素B6后,转变为尼克酸能力恢复较慢,其他现象快消失。
有50病例用4-脱氧吡哆醇(维生素B6拮抗剂),造成维生素B6缺乏,首先在眼、鼻、口部,逐渐发展到脸前额,眉十毛十及耳后出现皮脂溢出,有时会十陰十及十陰十囊部也有此现象。在胸部及其他潮十湿部位有擦烂,类似癞皮症的皮炎也间或出现在颈、前臂、肘及十臀十部。唇干、舌炎、口炎的症状与尼克酸缺乏症状相类似。其中有3人周围神经失调,首先是感官,然后运动功能失调。有些人十精十神状态不正常、淡漠、?ㄋ?、敏十感。摄食维生素B6缺乏膳者,其十性十格易激动,有抑制感,舌十乳十头肥十大。口炎,鼻腔皮脂溢出。
在一些动物试验中,出现于皮肤的缺乏象与缺乏必需脂肪酸者相似,但二者之关系尚不明了。高脂膳可以推迟维生素B6缺乏症象的出现,高蛋白饲料更易诱导出典型的皮肤症象及死亡。
表5-17 一些食物中维生素B6含量μg·100g可食部-1
| 食物 | 维生素B6 | 食物 | 维生素B6 | 食物 | 维生素B6 | |||
| 肉类: | 肉肝(生) | 840)840 | 谷类: | 面包 | 40 | 蔬菜: | 菜花 | 210210 |
| 牛腿肉(生) | 330330 | 全麦面包 | 180 | 洋白菜 | 160160 | |||
| 牛肾(生) | 430430 | 米(强化) | 170 | 生菜 | 5555 | |||
| 牛心 | 250 | 面粉(强化) | 170 | 豌豆 | 160 | |||
| 猪腰 | 350 | 黄豆粉(脱 脂) | 60 | 土豆 | 250 | |||
| 猪肝 | 650 | 水果: | 苹果 | 724 | 土豆 | 218 | ||
| 火腿 | 320 | 香蕉 | 30 | 南瓜 | 82 | |||
| 小牛肉 | 340 | 杏 | 510 | 萝卜缨(冻) | 100 | |||
| 羊腿肉(生) | 275 | 樱桃 | 54 | 豆 | 80 | |||
| 鱼: | 大比目鱼(生) | 430 | 柚 | 44 | 豆 | 560 | ||
| 金槍鱼(罐头) | 425 | 葡萄 | 34 | 玉米(罐头) | 200 | |||
| 鲑鱼(罐头) | 300 | 橙 | 80 | 菠菜(冻) | 150 | |||
| 禽: | 鸡肉(生) | 325 | 桃 | 60 | 西红柿 | 100 | ||
| 白肉部 | 683 | 梨 | 19 | 干果: | 枣 | 153 | ||
| 鸡蛋: | 全蛋 | 110 | 波萝 | 7414 | 桃干 | 100 | ||
| 蛋白 | 2 | 杨梅 | 55 | 葡萄干 | 240 | |||
| 蛋黄 | 300 | 甜瓜 | 86 | |||||
| 牛十乳十: | 脱脂牛十乳十 | 40 | 坚果: | 杏仁 | 100 | |||
| 牛十乳十 | 42 | 花生 | 400 | |||||
| 十乳十粉 | 300 | 核桃仁 | 730 | |||||
| 脱脂十乳十粉 | 360 | 饮料: | 啤洒 | 60 | ||||
| 人十乳十 | 20 | 洒 | 40 | |||||
(2)营养评价指标
①测定红细胞内需要PLP的酶,如谷草酰乙酸转氨酶(EGOT)或谷丙酮酸转氨酶(EGPT),后者的活力仅为前者的1/10。用外加PLP及不加PLP之比值作为指数来评价维生素B6营养情况:
EGOT指数=EGOT+PLP/EGOT-PLP
②测定维生素B6各类型间的转换所需的酶。如肝脑中PL激酶,磷解酶及PN氧化酶,其中仅PL激酶在维生素B6缺乏时有所降低。
③测定血浆中PLP水平,他与肌肉中PLP之量平行,可代表维生素B6储存情况。虽然由于分析技术的发展可以测定血中维生素B6但尚在动物试验阶段。
④色氨酸负试验 摄入2~5g1-色氨酸正常人尿中黄尿酸不增加,维生素B6缺乏者尿黄尿酸排十出量增加。摄入5g色氨酸后,6h尿中黄尿酸如大于25mg为维生素B6不足的表现。
⑤尿中PA测定 尿中PA因年龄与十性十别而异、成十人(男十性十)排十出PA之量相当于摄入量的40~50%。青年女十性十约占摄入量的25~35%。青春期前的女孩排十出量占摄入量的2.5~6%。
维生素B6的营养评价指标列于表5-18。
(3)需要量 美国提出供应量标准成十人为2mg,孕妇与十乳十母为2.5mg,婴儿0.3~0.4mg,人工哺十乳十者0.4mg,男十女孩7~9岁时为1.25mg,但使各组织达到饱和的剂量不同。大鼠下列组织达到饱和时的剂量,以每公斤饲料中含量计:肌肉2.4mg,肝4.8mg,十乳十腺和牛十乳十9.6mg。
表5-18 成十人维生素B6营养状况评价
| 边缘状态 | 可接受状况 | |
| 色氨酸负荷试验 | ||
| 尿中黄尿酸mg·d-1 | >50 | <25 |
| 尿中犬尿氨酸mg·d-1 | >50 | <10 |
| 尿中3-OH犬尿氨酸mg·d-1 | >50 | <25 |
| 吡啶-2-3-二羧酸μm·d-1 | >50 | <25 |
| 尿中排十出量 | <0.5 | >或=0.8 |
| 4-PAa mg·d-1 | ||
| 血中测定 | ||
| EGPT指数 | 〈1.25 | >或=1.25 |
| EPGT指数 | 〈1.5 | >或=1.5 |
| 血浆维生素B6mg·d-1 | 〈25 | >或=50 |
影响维生素B6需要量的因素有下列几种:
①膳食组成的影响:蛋白质摄取量高,维生素B6需要量也增多,如摄取100g蛋白质,每日应摄取1.75~2mg,低蛋白时为 1.25~1.50mg。
②激素的影响:口服雌十激十素类避孕药可以导致15~20%服药者的色氨酸代谢不正常,说明维生素B6=可以使75%色氨酸代谢不正常者恢复正常,给以30mg者,可以全部纠正。但给以正常供应量2mg维生素B6,血浆PLP,红细胞转氨酶正常。所以认为雌十激十素抑制色氨酸代谢中的犬尿氨酸酶。高甲状腺素者维生素B6辅酶活力减低,维生素B6需要量也增多。
③药物的影响:使用异烟肼治疗肺结核时,发生周围神经炎,补充维生素B6可以预防。环丝氨酸(抗结核药)所引起的神经上的不正常,尿中维生素B6排十出量增多,大剂量维生素B6可以预防。
④怀孕:在妊十娠后期,妇女的PLP浓度比未怀孕者要低,色氨酸代谢物从尿中排十出增多,血浆PLP在怀孕一周后增加,在分娩时降低水平,哺十乳十期仍然很低,可用每日2~5mg剂量纠正之。
⑤年龄:年龄可能导致维生素B6代谢上的变化,使组织中维生素B6水平偏低。小白鼠试验证明老年的动物PLP的磷酸活力增加,使肝中PLP减少。
⑥酒十精十的影响:嗜酒者血液中维生素B6水平低。大鼠试验证明不拘维生素B6摄取量多少,酒十精十使血浆及肝中PLP水平降低。
(4)临十床十应用 癫痫(Seicure)可能由于在中枢神经系统中,PLP对于谷氨酸脱氨酶的脱辅基酶蛋白不能结合,使γ-氨基丁酸(GABA)减少,GABA为中枢神经系统递质的抑制剂。早期给以大剂量维生素B6(10~25mmg),可以治疗。婴儿由于母亲维生素B6摄取量不足,十奶十中维生素B6缺少,或者人工哺十乳十者在加工及储存过程中,食品中维生素B6破坏等情况都可引起婴儿癫痫发作,可用2mg维生素B6治疗之。镰状红细胞也可以用大剂量维生素B6防治。缺铁十性十贫血症患者,给以2.5mg或更多的维生素B6,有利于血红素至少及红细胞的形式,但不能使之完全恢复正常。用左旋多巴胺治疗帕金森病若同时服用维生素B6,可减轻其副作用。亦有用于治疗怀孕期的呕吐、恶心,在有些情况如黄嘌呤尿、胱硫醚尿、高胱氨酸尿、高草酸尿、脉络丛及视网膜的环形萎十缩(gyrate atrophy),有时给以维生素B6有效。
一般说来维生素B6毒十性十很小,每斤体重1gPN对狗、大鼠及兔子都无不十良影响。PM毒十性十虽大,一般为PN2倍,但仍属于毒十性十很小的物质。但根据最近的报道,狗服用大剂量PN后,感觉神经传导的速率减慢,背侧神经?涞母霰鹣宋?的髓磷脂损失,病人服用大剂量(每日服用2~6g,持续时间为4~40月)有共济失调,远侧肢十体的位置与震动感觉功能损失,腱反射消失等感觉神经病。关于大剂量维生素B6的毒十性十问题值得进一步观察。
5.10 叶酸
5.10.1 结构与十性十质
叶酸亦称蝶酰谷氨酸,他的结构式如图5-30。为黄色结晶,不溶于冷水,但其钠盐很容易溶解。在PH4以下被分解为其组成物:蝶啶(pteridine)、对氨基苯甲酸及谷氨酸。在PH5以上比较稳定。他不存在于自然界中也无生物活十性十;但为具有生物活十性十的叶酸盐(floate)的前体。从病毒到人都需要叶酸盐,它是-碳化合物转移的中间体。将叶酸盐必须有下列三点:①将吡嗪环还原为二氢及四氢叶酸两种形式。二氢叶酸(dihydro folate,fh2)在哺十乳十类动物中组织中的二氢叶酸还原酶作用,在NADPH参与下,还原为四氢叶酸(teetahydrofolate,THFP);②将谷氨酸的数目增多,可增到7个;③在N5或N10处联结1-C基十十团十十。有些叶酸盐类似物如氨基蝶呤、氨甲蝶呤等能与二氢叶还原酶发生不可逆的结合,阻止了四氢叶酸的生成,从而抑制了1-C基十十团十十的转移。
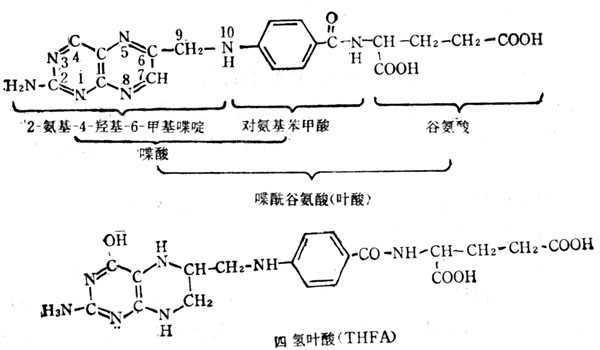
图5-30 叶酸和四氢叶酸的结构式
5.10.2 代谢
食物中叶酸盐为谷氨酸结合型者,在消化道内被上皮细胞溶酶体结合分解成单谷氨酸,再还原至THFA,才被小肠吸收。在血及组织液中主要为N5-甲基THFA。在细胞内者以多谷氨酸形式贮存。体内储存约5~10mg,其中一半储存于肝内,但通过细胞壁运输时,被血浆或组织中结合酶所分解。血清中有两种叶酸盐结合蛋白,一种结合量大但亲和十性十较小;另一种结合最小但亲和十性十大。前者为白蛋白,后者为β-球蛋白。血清中结合蛋白对氧化型叶酸盐(FH2)的亲和力较还原型者(THFA)要大,可能由于把氧化型的运输至肝内加以还原。血清中叶酸盐含量男十女成十人儿童之间无区别,但孕妇中结合能力增加,血清叶酸盐含量较高。新生儿的血清结合能力高,血清及红细胞中叶酸盐水平都是最高的。
体内的叶酸盐与细胞中蛋白结合,或在细胞膜上,或在细胞内。
(1)细胞膜上结合蛋白 小肠上皮细胞膜,脉络膜,肝、肾细胞膜上都有这种蛋白。肾中结合蛋白可能与肾小管叶酸再吸收有关。腹腔注射[3H]叶酸盐后0.5h,放射十性十在核及微粒体膜上,但稍长时间后,大多数叶酸盐与细胞浆及线粒体的蛋白相结合,叶酸盐为还原型及含多谷氨酸,这个现象说明叶酸首先与质膜上的蛋白相结合,而进入到细胞内。
在脑脉络丛的质膜中,也有可以与叶酸结合的蛋白。他与N5-甲基THFA)与蛋白相结合。在肝中也有结合蛋白,主要在肝的线粒体及胞浆部分。胞浆部分的蛋白用十十交十十链葡萄聚糖胶G-150柱层析法分成三部分,即FBP-CⅠ、FBP-DⅡ及FBP-CⅢ。线粒体部为MFBP。结合的叶酸为多谷氨酸者的,未结合者为单谷氨酸者。FBP-CⅡ部分在肝中最多,其次为肾。叶酸盐供应不足时,其蛋白量不减,未结合之叶酸盐减少较多,结合者减少较少。MFBP,进一步用DEAE-纤维素层析法可分成二部分:一部分与2甲基甘氨酸脱氢酶相结合;另一部分与四基甘氨酸脱氢酶相结合。但是否参与这些酶的反应,尚待进一步探讨。
叶酸盐在尿中及胆汁中排十出。排十出物在尿中主要为乙酰氨基苯甲酰谷氨酸(Acetamidcbenzoyglutamicacid),但也观察到注射标记的叶酸盐后,大部分放射活力从胆汁中由不具有生物活十性十的物质排十出,其十性十质尚不明了。
5.10.3 生理功用
THFA可携1C基十十团十十,他是1C基十十团十十转移的中间物。
(1)丝氨酸与甘氨酸的转变 丝氨酸通过转羟甲基酶作用,将β碳原子转移至THFA上,并脱十去一分子水,形成亚甲基THFA及甘氨酸,这个反应为可逆的,也可由甘氨酸合成丝氨酸。
(2)组氨酸中间代谢上的作用 组氨酸中间代谢产物N-亚氨甲基谷氨酸与THFA作用,生成N5-亚氨甲THFA及谷氨酸。
(3)高半胱氨酸与N5-甲基THFA作用合成蛋氨酸及THFA,在此反应中需要维生素B12参加,先将N5-甲基THFA高半胱氨酸转移酶上,然后再转移到高半胱氨酸上合成蛋氨酸,同时将N5甲基THFA变成了THFA。
(14)嘌呤的合成 从5-磷酸核糖焦磷酸起始,经过一系列酶促反应生成嘌呤核苷酸,其中有些步骤需要THFA衍生物将1-C基十十团十十转移,即嘌呤的2,8位C来源于THFA衍生物所携带的1-C基十十团十十。
(5)胸腺嘧啶核苷酸的合成 胸腺嘧啶核酸由尿嘧啶核苷酸,通过胸腺嘧啶核苷酸合成酶(thymidytesynthetase)作用,以维生素5,10亚甲基THFA为甲基供体转变而来。这个反应中所生成的FH2,为FH2还原酶催化,由NADPH供给氢,还原为THFA。
叶酸盐的缺乏导致巨红细胞十性十贫血,这种形态上的改变,可能由于叶酸盐缺乏影响核酸代谢,尤其是对胸腺嘧啶合成的影响所致。胸腺核苷酸为DNA合成的关键。细胞中有胸腺嘧啶激酶,可使细胞摄入已形成的胸腺嘧啶。这一途径对重新利用细胞破坏后分解出来的胸腺嘧啶提供可能十性十,但为胸腺嘧啶核苷酸的合成所抑制。若将脱氧尿嘧啶加入到正常骨髓细胞培养基中,由于可以合成胸腺嘧啶,因而抑制了已有的胸腺嘧啶纳到DNA。巨红细胞十性十贫血病人不能由尿嘧啶合成胸腺嘧啶,因此,不能抑制已有的有胸腺嘧啶的纳入。这个试验说明了正常人的骨髓细胞功能与患者不同,以及叶酸盐缺乏所导致的巨红细胞贫血的可能发病机理。
5.10.4 来源
叶酸盐在自然界广泛存在,动物物中都有。肝、肾、绿叶蔬菜、土豆、麦麸等含量丰富,但在自然界中为多谷氨结合型者。在烹调中及暴露于空气及光中易被破坏。在长时间烹调或作罐头的过程中,可破坏50~95%。牛十乳十可用巴氏消毒法毒后,含量约为168.9nmol/L,但煮沸1min,损失2/3。加入维生素C钠盐可以预防破坏,亦有利于叶酸的还原。
5.10.5 需要量
叶酸赵最低需要量为50μg,婴儿50μg,1~3岁100μg、4~6岁200μg,7~10岁300μg、孕妇800μg。FAO/WHO提出供应量为:成十人200μg(完全吸收情况下)、婴儿50μg、儿童100μg、孕妇400μg、十乳十母6~8倍。出生时红细胞中叶酸衍生物浓度最高,早产婴儿没有正常新生儿高。在怀孕最后几周内及哺十乳十期从母体运输至胎儿的量增多,十乳十中也有叶酸盐结合蛋白,有利于叶酸盐从母亲血液中输入至十乳十中,在十乳十中叶酸盐与蛋白结合,使其不易为肠道细菌所利用,便于婴儿吸收。所以妊十娠末期,十乳十母需要量增加,生长期儿童及青春期叶酸需要量都增加。
由于叶酸供应不足,妊十娠末期产娠早期易有巨红细胞型贫血。某些药物及叶酸类似物如抗癌药4-氨基-N10-甲基-叶酸(methotrexate,MTX)及抗疟药2,4-二氨基-5-(氯苯基)-6-乙基嘧啶(pyrimethamine),都对叶酸盐有拮抗作用。美国禁止使用大剂量叶酸,不得超过400μg。由于他虽可以治疗维生素B12的神经疾患,为了避免大量叶酸可以掩盖维生素B12之不足,所以不主张用大量的叶酸。
5.11 维生素B12
5.11.1 结构与十性十质
维生素B12(VB12)为钴胺素(Cobalamin)类化合物,他的分子中有4个还原十性十吡咯环联结在一起,这种构叫做咕啉,他与核苷酸(二甲基苯异咪唑)及核糖相联,另一方面与D-1-氨基-2-丙醇相连,钴与核苷酸之N相偶联(图5-31)。化学上称氰钴胺素为维生素B12,除CN后称钴胺至少。CN可为其他基十十团十十代替,成为不同类型的钴胺素。一般称对哺十乳十类有生理作用的为钴胺素,称对哺十乳十类及微生物都有作用的为维生素B12。本文中维生素B12泛称此类物。
氰钴胺至少自然界很少,为人工合成产品,可从其他类型转换而来。他是红色结晶,其活力为重金属及氧化还原剂所破坏,但在短期高十压消毒(12℃)不被破坏,能溶解在1:80水中,溶液为中十性十,在PH4.5~5时最稳定。
辅酶B12(即5‘-脱氧腺钳钴胺素)(图5-32)及甲基B12(甲基钴胺素)为哺十乳十类(人类)组织中最主要的辅酶形式。前者在线粒体内,后者在胞浆内,为合成蛋氨酸所必需者。它们对光不稳定,光解后形成水钴胺素。在氰存在下变成氰钴胺素,维生素B12、B12a、B12b、B12c都可治疗维生素B12的缺乏。
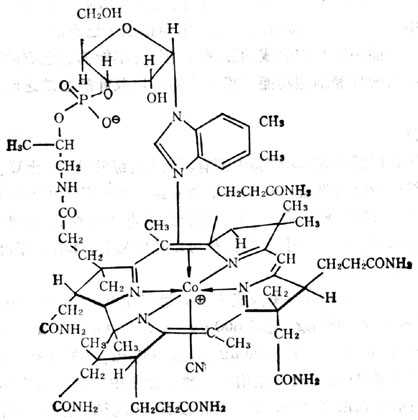
图5-31 氰钴胺素分子式(CN可以其他基十十团十十代替)
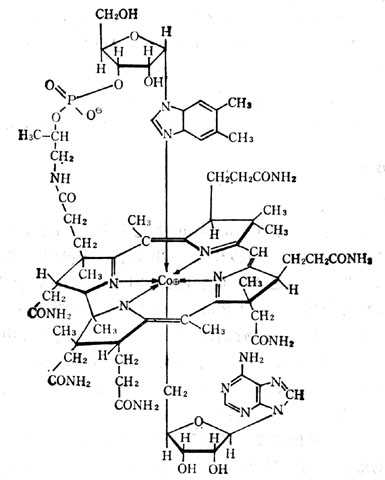
图5-32 辅酶B 12分子式
5.11.2 代谢
食物中维生素B12与蛋白质结合,在胃酸与胃蛋白酶作用下释放出来,又与胃中R蛋白结合,在PH2与8情况下,维生素B12与R蛋白亲和力要比与内因子(Intrinsicfactor,IF)的亲和力分别大50与3倍。因此,维生素B12不能从与R蛋白结合转至IF结合。在小肠中维生素B12-R复合物分解,在10min内维生素B12转移与IF结合。在小肠中维生素B12与IF结合。R蛋白不但在胃中有,唾液、胆汁及其他人十体十液中也有。IF与胃粘十膜壁细胞内质网系统相联系,维生素B12-IF对蛋白酶很稳定。有及猪的每gIF可结合30μg维生素b 12进入肠细胞内,在细胞表面游离的IF又可与维生素B12结合。但有人认为IF也进入细胞内。
维生素B12从肠细胞排十出到门静脉与血浆中结合蛋白结合。人血浆中有三种维生素B12运输蛋ⅠⅡⅢ(即transcobalaminⅠ、Ⅱ、Ⅲ;TCⅠ、TCⅡ、TCⅢ)。TCⅠ即血浆R蛋白,血浆中80~100%的维生素B12与之结合。TCⅡ在肝中合成,1molTCⅡ与1mol维生素B12或其类似物相结合,血浆中只有10~20%的维生素B12与之结合,它的主要作用是将维生素B12从肠运输至其他组织,如肝、肾、能髓、红细胞、胎十盘等。在这些靶组织上有他的受点,将TCⅡ-维生素B12包入,在溶酶体内将其分解,但有人认为分解的场所为溶酶体膜或胞浆内。
TCⅠ及TCⅢ的功用可能一方面保护维生素B12不为细菌所用,另一方面可能将维生素B12类似物如类咕啉及钴胺酰胺从水消化道及体内清除出去。在体内清除是将TCⅠ(或TCⅢ)-维生素B12类似物的复合十体进入到肝细胞的溶酶体内将其分解,然后维生素B12类似物由肝排十出至胆汁中,其再吸收可能十性十不大,因IF与维生素B12类似物结合能力比较弱。
维生素B12消化吸收与运输,需要多种因至少参加,因此较易发生维生素B12缺乏。①从食物中摄取量不够,尤其长期素食者维生素B12很容易缺乏;②胃酸过少,不能分解食物中蛋白-维生素B12复合十体;③胃切除太多,没有足够胃粘十膜产生足够的IF;④胰蛋白酶量不足以分解R蛋白-维生素B12复合十体,以致IF与维生素B12结合减少;⑤回肠疾病,IF-维生素B12复合十体的受体减少,影响吸收;及⑥TCⅡ运输蛋白缺乏,影响体内运输。
5.11.3 生理功能
1)在人及哺十乳十动物中有二种生化反应需要维生素B12作为辅酶。
(1)甲基丙二酸与琥珀酸的异构作用
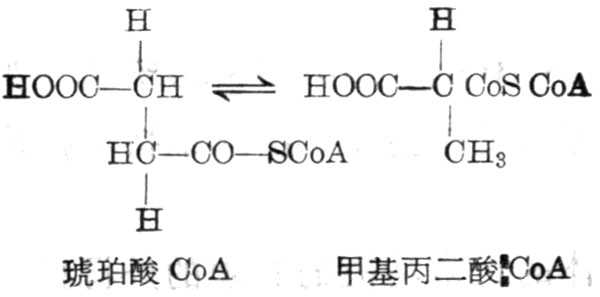
这一反应为可逆的,由甲基丙二酸CoA变位酶催化,其辅酶为辅酶B12,使分子内部重新排列。甲基丙二酸-CoA,可从丙酸、异亮氨酸、缬氨酸而来。甲基丙二酸变为琥珀酸CoA后,可进入到代谢途径。维生素B12缺乏者,尿中甲基丙二酸排十出量增多。
(2)高半胱氨酸甲基化变成甲硫氨酸(蛋氨酸) 高半胱氨酸在N5-CH3THFA及高半胱氨酸甲基转移酶作用下,接受甲基变成蛋氨酸。在这个酶系统中,甲基B12为辅助因子,还需要δ腺甘蛋氨酸及NADH。甲基从5N-甲基THFA转移至维生素B12,再转移至高半胱氨酸上而奕为甲硫氨酸。
2)维生素B12缺乏症与生化功能的关系 维生素B12缺乏并不是为巨红细胞型贫血及神经系统的疾患。神经系统的症状,起初为隐十性十的,先由周围神经开始,手指有刺痛感,后发展至脊柱后侧及大脑,记忆力右减退,易激动,嗅味觉不正常,运动也不正常等等。其主要原因为神经脱髓鞘。这个作用与已知的生化功能尚无明确的联系。
维生素B12缺乏的另一症象为巨红细胞型分血。缺乏维生素B12的贫血与缺乏叶酸者是一样的。现在用“甲基THFA陷阱”假说来解释,在高半胱氨酸转变为蛋氨酸的反应中,N5-甲基THFA,将甲基转移出去,变成THFA,这个反应需要维生素B12参加,如果维生素B12缺乏,这个反应不能进行,N5-CH3THFA不能转变为THFA,而且N5-CH3THFA为体内THFA的主要储存形式,所以导致叶酸(THFA)功能十性十的缺乏,不能形成其他THFA衍生物以携带1-C基十十团十十,而影响体的一些代谢,如嘌呤及胸腺嘧啶核苷酸的合成及组氨酸的代谢等。
5.11.4 来源
植物十性十食品中维生素B12含量甚少,豆类根瘤菌可合成一些。肉及十乳十中较多,人结肠中的微生物可以合成维生素B12,但不能吸收,在粪便中排十出。素食者可能从微生物污染的食物及水中获得一些。食物中维生素B12主要为辅酶B12或甲基B12,而且与蛋白质相结合,对热稳定,在碱十性十中不稳定,在维生素C存在于也不稳定。牛十乳十经巴氏消毒法损失7%,煮2~5min损失30%,119~129℃消毒13min损失77%,但快速消毒(143℃)仅损失10%。
5.11.5 需要量
维生素B12体内储存量为1~10ng,其中50~90%存于肝内。辅酶B12为主要储存形式,甲基B12为运输形式。体内储存的维生素B12,可维持不摄取维生素b 12者的健康达3~6年之久。
最低需要量为维持正常机体的正常功能的必须的外源摄入量。维生素B12最低需要量为0.1μg·d-1。
最低需要量(单位·d-1)=(体内可利用的储存量)/停止摄取后到发生缺乏的时间)(日),
美国供应量,成十人、儿童、孕妇分别为3、2、4μg(估计食物中维生素B12有50%被吸收),FAO提出供应量成十人为2μg,1~3岁0.9μg,4~9岁1.5μg,10岁以上2μg,孕妇3~4μg,十乳十母2.5μg,婴儿(人工喂养)0.3μg。
5.12 维生素C
5.12.1 结构与十性十质
维生素C又名抗坏血酸(Ascorbic acid,VC),为水溶十性十的,不易溶于乙醇,不溶于脂溶剂中。维生素C在抗坏血酸作用下脱氢,转化为脱氢抗坏血酸(DHVC)(图5-33)。
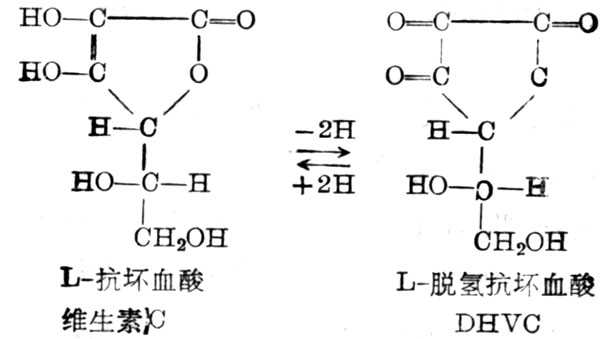
图5-33 维生素C的构造式及其氧化还原
许多动物能合成维生素C。人、猴及豚鼠不能合成,需要从外界摄取,它很容易氧化,加热、暴露于空气中,碱十性十溶液及金属离子Cu2+、Fe3+,都能加速其氧化。维生素C氧化为DHVC,这一反应为可逆的,因此在体内形成氧化还原系统,然后再由DHVC氧化到二酮古洛糖酸(dikotogulonicacicd),草酸等。
5.12.2 代谢
维生素C在体内的保存率与剂量有关,剂量有关,剂量愈小,在体内保存率愈高,可以完全不从尿排十出。摄取100mg,可以完全保留在体内。180mg时保留76%,1.5g,保留50%,大剂量时未被吸收者残留在肠内,影响渗透压,可引起腹泻。维生素C已饱和者注射1g维生素C,收集24h尿,测定其生物半衰期为337h,24h内排十出剂量的83%,其中84%为维生素C,其他为维生素C硫酸酯及草酸。在正常情况下,维生素C体库为1500mg,其大小不随身十体大小而变化,分布在体内水溶液部分,以肾十上十腺、胰、脾、唾液及十睾十丸的浓度最高。维生素C缺乏时,浓度下降,豚鼠每日给予25及250mg维生素C,肾十上十腺及脑下垂体浓度上升,其他组织浓度不变,有些报告也认为组织及眼球维生素C,肾十上十腺及脑下垂体浓度上升,其他组织浓度不变,有些报告也认为脑组织及眼球维生素C浓度剂量上升,在脑中以浓度为最高。
当大量的维生素C摄入后,体库饱和,从尿中的排十出,在血浆维生素C浓度低时,肾小管可将其吸收,血浆浓度升高到1.4mg%,肾小管不再吸收,以防止血浆浓度再上升,从尿中排十出。Ginter认为最大的体库,应为所有组织达到饱和状态,每日300~600mg,即可达到这种水平,体库存为5g。尿中主要排十出物除维生素C、DHVC外,尚有维生素C通过血脑屏障碍有关,游离维生素C能不迅速通过。人类维生素C的排十出途径主要为尿,大便中维生素C及通过呼吸道(以CO2形式)排十出均甚少。豚鼠但从尿中排十出,也可从肠道及呼吸道中排十出,说明豚鼠可以将维生素C完全氧化分解。
5.12.3 生理功能
(1)氧化还原作用 在生物体内,维生素C/DHVC的氧化还原反应与巯基(——SH)/双硫键(——S——S)系统相联系。因此维生素C可使体内——SH水平提高。维生素C在体内可能有清除自十由基的作用,有些化学物质对机体的损害,都涉及到自十由基的作用,如氧、臭氧、二氧化氮、洒十精十、四氯化碳及抗癌药中的阿拉霉素对心脏的损伤。维生素C作为体内水溶十性十的抗氧化剂,可与脂溶十性十抗氧化剂有协同作用,可能在防止脂类过氧化作用上起一定的作用、人眼晶体在光的作用下,也可产生O2的自十由基,可能为白内障产生的原因。这些自十由基在正常情况下为体内抗氧化剂如维生素C、麦胱甘肽所清除、所以大量的维生素C可以阻止这种过氧化作用的破坏。
(2)维生素C对结十缔十组十织的影响 维生素C对结十缔十组十织中胶原蛋白及基质中酸十性十粘多糖的合成都有影响。
①维生素C与胶原蛋白合成的关系:成纤维细胞合成的肽链中,部分脯氨酸及赖氨酸须分别经脯氨酸羧化酶及赖氨酸羧化酶的作用转变为羧脯氨酸及羧赖氨酸,这类酶需要α-酮戊二酸、氧、Fe2+等因素的参加,维生素C不参与反应,它能使酶Fe2+复合十体中的铁保持2价。维生素C缺乏对快速生长的胶原组织,如伤口命愈合等有明显的影响。
②维生素C与胶原蛋白合成的关系:维生素C对透明质酸有氧化还原解聚作用。维生素C作用为分解透明质酸与蛋白质结合的大分子,因而增加皮肤的渗透十性十。维生素C也是影响硫酸十软骨至少的形成,兔子喂以胆固醇饲料后,注射维生素C者主动脉基质中硫酸肝素及硫酸十软骨素-4,都比注射生理盐水者要高,维生素C硫酸酯可能与体内硫酸化有关。
(3)维生素C与某些药物代谢的关系
①维生素C对肝微粒体酶系统的影响;一些脂溶十性十药物在肝微粒体酶系统作用下,进行羧基化及去四基化,成为极十性十化合物后,易于从胆汁及尿中排十出解毒。有机氯杀虫剂能透发微粒体酶活力。但此酶系统对维生素营养情况反应比较敏锐。维生素C缺乏的程度尚未达到体重下降时,微粒体中羟基化酶系统的活力已下降,其中以细胞色素还原酶的减少最多,约减85%,补充维生素C后,组织中维生素C量在较短时间内恢复正常,但酶活力恢复较慢。
②对组胺的作用:维生素C影响组胺的分解代谢,因此有去组胺的作用。当喂豚鼠以无维生素C饱粒时,组织中维生素C水平降低而组胺水平上升。缺乏维生素C10~12日,组胺水平达到高十峰,并维持此量,但若给以一次维生素C5mg·100g体重-1的剂量,可使组胺下降到正常水平。在一些应激十情况下[如给以某种药物,毒素,冷(6±1℃)、热(39±1℃)环境,怀孕及烧伤等],若不给以维生素C,血中组胺上升(约为110~160ng·ml-1),但给予维生素C5mg·100g体重-1,组胺水平不上升(70ng/ml)。组胺有一定血管扩张作用,因而可增加血管的渗透作用。
③防止联苯胺、萘胺及亚硝盐的致癌作用:合成4-氨基联苯胺及2-萘胺的工人易患膀十胱癌。因而怀疑这些物质的代谢产物,如邻羧或羟胺基的化合物,在尿中可能为膀十胱的致癌物质,食物中色氨酸某些代谢产物,移植于小鼠膀十胱中,也容易生癌。这些代谢物质容易氧化生成致癌物质,但若同时有一定量维生素C存在时,可以阻止其氧化。例如将羧基β苯胺的饱和溶液保十温十2h,可迅速氧化,但与20mg%维生素C一起保十温十,可以防止其氧化。如每人每日摄取量300mg时,尿中维生素C含量为4~C5mg%,可防止这些代谢物氧化。
众所周知,亚硝胺对动物有致癌作用,加工腊肠添加亚硝酸盐以使其色红,食物中的硝酸盐经过微生物作用可产生亚硝酸盐。亚硝酸盐可以与仲或叔胺作用,在胃中形成亚硝胺,这类物质有致癌作用。在食物添加剂及杀剂中常含有这些胺类。维生素C可与胺竞争,与亚硝酸盐作用,因而阻止亚硝胺的产生。但它须与亚硝酸盐同时存在于胃中,其浓度唯分子量计,应为亚硝酸盐的2倍。
④与芳十香族氨基酸代谢的关系:酪氨酸为非必需的氨基酸,可以由苯丙氨酸羟化转变而来。这个羧化过程中需要四氢喋啶参加,但逐渐氧化失去作用,维生素C及NADPH将其还原,恢复其作用。
酪氧酸在分解代谢中,先经氨基转换酶作用变成对羧基丙酮酸,再变为尿黑酸,在些过程中有羧基化步骤,需要β-羧基丙酮酸氧化酶及其他因素,如O2、α-酮戊二酸、Fe2+。维生素C为维持Fe2还原为状态。酪氨酸量少,维生素C缺乏时也可以进行分解代谢,但酪氨酸大量时,则需要维生素C。
体内一些具体生理作用的儿茶酚胺,由酪氨酸转变而来,酪氨酸羧基化变为多巴,然后去羧基变成多巴胺,再羧化为去甲基肾十上十腺素,再甲基化变化肾十上十腺素。维生素C营养状况与这些羧基化作用有关。维生素C摄取正常量时,其酪氨酸羧化酶(肾十上十腺、肝、脑中者)的活力约为缺乏组织的2~4倍。但在体外试验维生素C不能促进其活力。维生素C促进酪氨酸及色氨酸的羧基化作用与促进苯丙氨酸羧基化的作用机理是一样的。都是把在羧基化过程中,被氧化的喋啶还原成四氢喋啶。多巴胺转变成去甲肾十上十腺素需要的多巴-β-羧化酶。氧、维生素C、延十胡十索酸为辅助因素。多巴-β羧化酶是一个含铜蛋白,铜必须为Cu2+,而在羧基化过程中Cu2+→Cu2+,维生素C将基还原成Cu2+。。
⑤维生素C对环磷腺苷(cAMP)的作用:维生素C可使cAMP值增高,由于它能抑制磷酸二酯酶的作用,维生素C与cAMP有相似的结构,两者可竞争磷酸二酯酶上的作用点。如果二者所占的位置已达饱和,则互相竞争。当维生素C血浆浓度达到10-4mol(相当于2mg%),能阻止化酶对cAMP的分解作用。cAMP与cAMP结构也相似,也有竞争作用,所以维生素C增加时,占用了一部分磷酸二酯的作用点,以致cAMP与cAMP也竞争,而有拮抗作用。
(4)维生素C对心血管系统的作用 心肌维生素C含量很少,但血管丰富,维生素C可由白细胞供给,心肌梗塞病人,在发作后12h内,白细胞中维生素C降到低水平。大剂量注射维生素C可降低急十性十克山病人的死亡率。将患过心肌梗塞病人(40人)分成三组,一组不补充维生素C,第二组补充1g维生素C,第三组补充2g维生素C,试验期计共计6个月。第二组血清维生素C上升,但血纤维蛋白溶解能力及血中脂类无改变。第三组血脂类无改变。第三组血清维生素C上升96%,血维生素溶解能力增加45%,血小板聚集指数下降27%,胆固醇下降12%,β-脂蛋白(LDL)下降,HDL上升。但停止供应后,又恢复到以前的水平。国内外一些作者都观察到长期维生素C供应不足,虽可豚鼠体重,但在主动脉及心脏动脉壁有明显粥样硬化病变。有些作者还观察到这些缺乏动物,血、肝及皮肤内胆固醇的含量都显著高于维生素C正常供应者,饲以高脂(胆固醇)饲料的豚鼠的组织中,胆固醇的含量也以维生素C缺乏都多,而给大剂量维生素C者(每日50mg)较低。因此,认为维生素C影响胆固醇的7位羧基化,使其转变为胆酸的能力减少,不能阻止胆固醇分解及排十出,而使其在体内积累。但有些文献报告使用大剂量维生素C不能降低血胆固醇。
5.12.4 来源
新鲜植物中维生素C较多,由于植物中的有机酸及其他抗氧化剂可以保护它免于破坏。在烹调与储存过程中容易损失,新鲜土豆,维生素C含量较多,储存4个月,仅剩4个月,仅剩1/2量,绿叶蔬菜更易损失,菠菜储存2日后,损失2/3。中国的烹调方法,其保存率在50~70%。其酯类衍生物比较稳定。6位棕榈酸酯用于抗油脂氧化。维生素C磷酸酯虽为水溶十性十者,在中十性十及碱十性十溶液中稳定,不被Cu2+、Fe2+等离子所破坏,甚至在烘烤过程中也不被破坏,又无毒十性十,具有与维生素C相同的生物的活十性十,可作为强化食品用。
维生素C以药片方式补充的效果比从膳食中摄取者的效果要差一些,组织中维生素C浓度要小一些。由于组织对维生素C摄取量有限,多次服用的效果比一次口服同样剂量的效果要好。
5.12.5 需要量及大剂量的副作用
根据英国的试验维生素C最低需要量为每日10mg,可预防坏雨血病的发生,但对于供应量的意见分歧较大。有人认为体库为1500mg,每日转换率为3%,供应量应为45mg。我国曾对56名维生素C营养情况不十良青年进行10周不同维生素C剂量的补充,测定血浆、白细胞及尿维生素C浓度。根据这三个指标,供应量为70mg,可以保证机体维生素C营养比较充裕,血浆维生素C约为0.8mg%,白细胞维生素C28mg以上,尿排十出量不高,机体能充分利用,十浪十费较少。
由于上述的维生素C的一引起生理功能,临十床十上有时使用大剂量维生素C。人十体服用后,副作用不大。有人认为草酸为维生素C代谢的产物,从尿中排十出,可能与钙生成草酸钙而形成尿结石,但维生素C摄取量低于4g时,尿中草酸量并不增加、此或由于维生素C排十出量增多时,使尿的酸十性十增加,则草酸钙溶解度易形成这二种结石,也易激发痛风。在体外试验时未加盐酸,尚不能说明胃中的情况。在各类型的维生素B12中,只有水钴胺素可被维生素C破坏,但它在生物体内含量不多,所以维生素C对维生素B12影响,在体内不很大。但在某些疾病时,水钴胺素为储存的主要形式,维生素C可能对维生素B12有不利的影响。动物吃高糖饲料时,大剂量维生素C使血。尿及肝中DHVC含量明显增加,可导致动物死亡。大量注射DHVC,使胰岛上的β-细胞退化,血糖增高。吃高谷类膳的人,给予大剂量维生素C后,也可使血中DHVC增加。膳食中以蛋白质代替一部分糖时(如15%酪蛋白膳),则无此现象,所以吃普通膳食时,无此副作用。
大剂量维生素C可能增加机体对维生素E的需要量。人服用5~10g维生素C时,不能吸收,由便排十出,以致恶心呕吐。聚骤然停服大剂量,体内代谢仍停留在高水平,较快地将储存量用光。若母鼠在怀孕及哺十乳十期都给予大剂量维生素C,子鼠断十乳十后,喂无维生素C饲料,维生素C缺乏症状及死亡的出现时间比一般豚鼠要早一些。所以若停服维生素C或减低剂量时,应当逐渐地减少,使机体有适应过程。
5.13 泛酸与生物素
B族维生素中尚有泛酸及生物素,它们具有很重要的生理功能,但由于来源广泛,人十体未发现有典型的缺乏病例。
5.13.1 泛酸
泛酸是丙氨酸藉肽键与α,γ-二羧-β-β-二甲基丁酸缩合而成,它是辅酶A(CoA)及酰基载体蛋白(acyl carrier protein,ACP)的组成部分。机体内的泛酸,几乎都用以组成辅酶A及ACP的辅基,其构造式如图5-34。
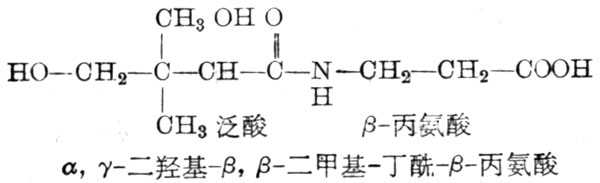
图5-34 泛酸分子式
辅酶A参与糖、脂类及蛋白质的代谢。在糖代谢中丙酮酸转变为乙酰辅酶A,由此可合成脂酸,或与草酰乙酸形成柠檬酸进入三羧酸循环。12种氨基酸(丙、甘、丝、苏、半胱、苯丙、亮、酪、赖、色、苏及异亮氨酸)的碳链分解代谢都形成乙酰辅酶A。
脂肪酸分解与合成都需要辅酶A参加,在脂肪酸合成时,ACP与其他脂肪酸合成所需要的酶形成一个或几个复合十体。这个体系以ACP为中心,其长的磷酸泛酰巯基乙胺侧链,俨然是一摆臂,把一个酶3分子中脂酰基转运到下一个酶分子上。
5.13.2 生物素
自然界的生物素有α、β二种,二者生理功能相同,在常十温十下稳定,但在高十温十和氧化剂作用下,可使其失去活十性十,它的化学结构如图5-35。生物素侧链的羧基与酶的赖氨酸的ε-NH2相结合,作为羧基转移酶及脱羧酶的辅酶(图5-36)。
图5-35 生物素
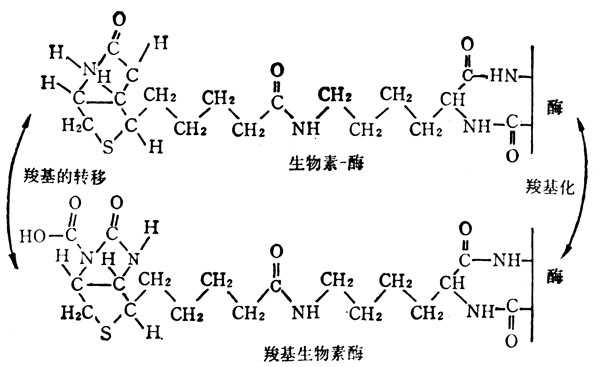
图5-36 生物素-酶与羧基生物素-酶参与羧基转移作用

受羧基的基十十团十十必须接受羧基的基十十团十十必须与另一羧基相邻。
这些羧化酶在哺十乳十动物代谢上有其重要十性十。例如,在脂肪酸合成的步聚中,乙酰-CoA转变为丙二酰-CoA需要乙酰辅酰A羧化酶。某些氨基酸代谢后生成丙酸,通过丙酰-CoA羧化酶余下而产生琥珀酸,再进行分解代谢。丙酮酸羧化酶不但能形成草酰乙酸进入三羧酸循环,而且还可合成门冬氨酸及形成磷酸烯醇丙酮酸以进行糖原异生。
羧基转移酶及脱羧酶的作用如下:

生物素来源广泛,肠道细菌也能合成,因此人类并未发现缺乏症。已报告的实例,生物素缺乏是人为诱发或摄入大量生蛋清的结果。在蛋清中含有一种碱十性十蛋白质,称为抗生物素蛋白,它与生物结合成为一种非常稳定,但无活十性十,难吸收的化合物。蛋清经加热后,这种抗生素蛋白被破坏,不能与生物素结合。
参考文献
1.Simpson K.L,Chichester CO:Ann Review Nutr.1:351,1981
2.陈仁??,王成发等:我国步兵维生素A需要量的研究军队营养专辑之二31,军事医学科学院军队卫生研究所天津,1980
3.Henry HL,Norman AW:Ann Rev Nut.4:493,1984
4.Machilin LJ,Brin M:Vitamin Ein;Nutrition and the Adult Micronutrients245,Edi.R.B.Alfin-Slater,D.Kritchevsky Plenum Press N.Y.U.S.A.1980
5.Olson REAnn,Rev.Nutr,4;281,1984
6.OlsonRE Ann,Rev.Nutr,4;281,1984
7.Neal RA,SauberlichH E:Thiamin In:ModernNutrition in Health andDisease1916th ed.Edi.R.S. GoodhartM.E.Shils Lea&Febiger PhiladelphiaU.S.A.1980
8.FlodinN W:VitaminB6 In:Vitamin/Trace/Proteins Interaction Vo14 135Eden Press Ine.Quebec Canada 1981
9.FlodinN W:VitaminB6 In:Vitamin/Trace Mineral/ProteinInteraction Vo14 135Eden Press st,Alb ans Vt.U.S.A.1981
10.Ink SL,HendersonLM:Ann Rev,Nutr,4:455,1984
11.Wagner C:Ann,Rev,Nutr.2;229,1982
12.Goulian M et al:Ncad.Sci.U.S.A.77:1956,1980
13.Sutharum B,Alpers:DH:Ann.Rev,.Nutr.2:243,1982
14.Flodin NW:Vitamin CIn: Vitamin/TraceMineral/Protein Interaction Vol.1488,EdenPrexx St Albans Vt.U.S.A1981
15.周德勤等:营养学报告4:99,1982
16.陶桂全等:中华预防医学杂志15:30,1981
17.周德勤等:军队卫生研究资料汇编(军队营养专辑之二)52,1980天津。
